
题目列表(包括答案和解析)
24、
 (8分)将4mol SO2与2 mol O2的混合气分别置于起始容积均为aL的甲、乙两容器中,发生反应:2SO2(g) +O2(g) 2SO3(g);△H<0。
(8分)将4mol SO2与2 mol O2的混合气分别置于起始容积均为aL的甲、乙两容器中,发生反应:2SO2(g) +O2(g) 2SO3(g);△H<0。
在相同温度下,使其均达到平衡状态。甲是恒压容器,乙是恒容容器。乙容器经50s达到平衡状态时,测得混合气体的物质的量为4.2mol。请回答:
(1)①在50s内,乙容器中O2的化学反应速率为 ,
乙容器达到平衡时SO2的转化率是 。
②甲容器达到平衡时其所需时间 50s(填“大于”、“小于”或“等于”)。
(2)达到平衡状态后,要使甲、乙两容器中SO2物质
的量相等,可采取的措施是 (填字母)。
A.保持温度不变,适当扩大甲容器的容积
B.保持容积不变,使乙容器升温
C.保持容积和温度不变,向乙容器中加入适量SO3(g)
D.保持容积和温度不变,向甲容器中加入适量SO3(g)
23.(12分)A、B、C、D、E为五种常见的短周期元素,常温下A、B可形成B2A2和B2A两种液态化合物,B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性恰好相反,C元素的焰色反应呈黄色,E与C同周期,且E的阳离子在其所在周期元素形成的简单离子中半径最小,试回答:
(1) D元素处于周期表的第_____________族;
(2) B2A2对应化合物的的电子式为_______________;
(3)液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X的电离方程式为____________________________________________________;
(4) 已知 A、D、E三种元素可以形成化学式为A9D3E的盐。A9D3E的水溶液呈________性,用离子方程式解释其原因_____________________________________;
(5)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,W的水溶液呈碱性,Q的水溶液呈酸性,且物质的量浓度相同的W、Q溶液中水的电离程度:前者小于后者,Q为______________(填化学式)。
22、下列说法正确的是
A.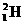 原子中的中子和质子的个数比为2∶1
原子中的中子和质子的个数比为2∶1
B. 在NaHCO3溶液中一定有:c (Na+) +c (H+) = c (HCO3-) +c (CO32-) +c (OH-)
C. NaOH与CH3COOH混合液中,可能出现:c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
D. pH=2盐酸和pH=12 Ba(OH)2溶液等体积混合,溶液pH一定等于7
第Ⅱ卷(非选择题,共80分)
21、某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)=2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了
A.20% B.40%
C.60% D.80%
20、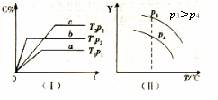 在某密闭容器中,可逆反应:2A
在某密闭容器中,可逆反应:2A  2B +C(g) 符合图象(I)所示关系。下列叙述正确的是
2B +C(g) 符合图象(I)所示关系。下列叙述正确的是
A.A为气态,B可能为气态
B.上述可逆反应的正反应的△H>0
C.图(Ⅱ)中,Y 轴表示A的转化率
D. 图(Ⅱ)中,Y 轴表示混合气体的平均相对分子质量
19、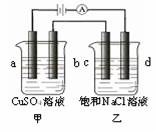 如图所示,a、b均为石墨电极,c为钛电极,d为碳钢电极,通电进行电解。下列说法正确的是
如图所示,a、b均为石墨电极,c为钛电极,d为碳钢电极,通电进行电解。下列说法正确的是
A.甲、乙两烧杯中溶液的pH均保持不变
B.乙烧杯中d的电极反应为 2Cl––2e–=== Cl2↑
C.乙烧杯中通适量HCl气体后溶液组成可以恢复
D. a极产生1.12L(标况)气体时,c极产生2g气体
18、 某氯化镁溶液的密度为1.2g/cm3,其中氯离子的质量分数为15%,300mL该溶液中Mg2+离子的物质的量约等于
A 0.38mol B 0.63mol C 0.76mol D 1.5mol
17、某可充电的锂离子电池以含锂的过渡金属氧化物(Lin-x MO2)为正极,嵌入锂的碳材料(C6Lin)为负极,含Li+导电固体为电解质。电池放电时的电极反应式为:
负极:C6Lin – xe- === C6Lin-x + xLi+ 正极:Lin-xMO2 + xLi+ + x e-=== LinMO2
下列说法不正确的是
A. 放电时,在电池内部Li+向负极移动
B.充电时,锂离子电池阴极反应为C6Lin-x + xLi+ + x e-=== C6Lin
C.放电时,锂离子电池的电池反应为C6Lin + Lin-xMO2 === LinMO2 + C6Lin-x
D.电池反应中,锂、锌、铅各失去1mol电子,金属锂所消耗的质量最小
16、下列叙述正确的是( )
A.同一周期的元素,原子半径越大,其单质的熔点一定越低
B.第110的元素的电子层数为7,是超铀元素
C.同一主族的元素,其氢化物的沸点逐渐升高
D.同一主族的元素,半径越小越容易失去电子
15、元素周期表中的短周期元素X和Y,可组成化合物XY3,下列说法正确的是
A.XY3一定是离子化合物
B.X和Y一定不属于同一主族,但可属同一周期,
C.若Y的原子序数为m,则X的原子序数一定为m±4
D.X和Y属于同一主族时,单质及XY3在固态时属于同一晶体类型
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com