
题目列表(包括答案和解析)
7.已知Cl2和NO2在一定条件下可以化合成一种气态化合物A。为了测定A的组成,进行如下实验:(1)当Cl2和NO2混合气体以不同比例混合时,测得其平均相对分子质量为51和61,则Cl2在上述混合气体中的体积分数分别为__________;1/5和3/5。
(2)取上述不同比例的混合气体各5 L,分别在一定条件下充分反应,气体体积均为4 L,则Cl2与NO2反应的化学方程式是:___________________Cl2+2NO2¾®2NO2Cl
6.在FeO、Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是
A.30% B.20% C.25.7% D.10%
当反应物以混合物的量的形式已知时,可利用极值假设,从而得到解题线索。54.3%
5.18.4 g NaOH和NaHCO3固体混合物,在密闭容器中加热到250℃,经过充分反应后排除气体,冷却,称得剩余固体质量为16.6 g,则原混合物中NaOH的质量分数为____
分析反应物、生成物的量的取值范围时利用极值法能达到目标明确,方法简便。
4. 在容积不变的反应容器中,要求通过调节体系温度使A(g)+2B(g) 2C(g)达平衡时保持气体总物质的量为12 mol,现向反应容器中通入6.5 mol A、x mol B和2 mol C,欲使起始反应向逆反应方向移动,x的取值范围为__________2.5
< x < 3.5。
在容积不变的反应容器中,要求通过调节体系温度使A(g)+2B(g) 2C(g)达平衡时保持气体总物质的量为12 mol,现向反应容器中通入6.5 mol A、x mol B和2 mol C,欲使起始反应向逆反应方向移动,x的取值范围为__________2.5
< x < 3.5。
两种气体组成的混合气体的平均相对分子质量介于组成气体相对分子质量之间。
三种气体混合的平均相对分子质量在组成气体相对分子质量最大值与最小值之间。
这个范围太大,依据题目内在关系和极值法可使范围更加准确。
3.0.03 mol Cu完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05 mol。该混合气体的平均相对分子质量是
A.30 B.46 C.50 D.66
将主要成分与杂质成分极值化考虑,再与实际情况比较,就可判断出杂质的成分。
2.将13.2 g可能混有下列物质的(NH4)2SO4样品,在加热条件下,与过量的NaOH反应,可收集到4.3 L(密度为17 g/22.4 L),则样品中不可能含有的物质是
A.NH4HCO3、NH4NO3 B.(NH4)2CO3、NH4NO3
C.NH4HCO3、NH4Cl D.(NH4)2CO3、NH4Cl
根据物质组成进行极端假设得到有关极值,再结合平均值原则确定正确答案。
1.某碱金属单质与普通氧化物的混合物共2.8 g,与足量水完全反应后生成3.58 g碱,此金属可能是
A.Na B.K C.Rb D.Cs
16.(2010年上海)工业生产纯碱的工艺流程示意图如下:

 w_w w. k#s5_
w_w w. k#s5_
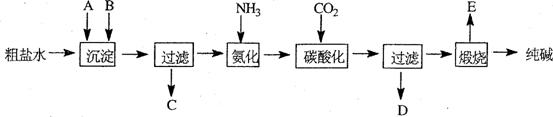
完成下列填空:
1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A B
2)实验室提纯粗盐的实验操作依次为:
取样、 、沉淀、 、 、冷却结晶、 、烘干。
3)工业生产纯碱工艺流程中,碳酸化时产生的现象是 。碳酸化时没有析出碳酸钠晶体,其原因是 。
4)碳酸化后过滤,滤液D最主要的成分是 (填写化学式),检验这一成分的阴离子的具体方法是: 。
5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为: 滤液D加石灰水前先要加热,原因是 。
6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(注明你的表达式中所用的有关符号的含义)

 w_w w. k#s5_
w_w w. k#s5_
解析:本题主要考查了物质的提纯、化学实验基本操作、实验结果的处理等知识。1)沉淀剂A源于石灰窑,说明是生石灰或熟石灰;粗盐中的镁离子和钙离子一般用碳酸钠除去;2)实验室提纯粗盐的整个操作过程为:取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘干几步;3)纯碱生产中碳酸化时,会看到溶液中析出晶体,这是由于碳酸钠的溶解度大于碳酸氢钠;4)根据操作过程,碳酸化后溶液中主要是NH4Cl;检验其中的氯离子时,要经过取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子;5)滤液中主要含有的是氯化铵,和石灰水反应时:NH4++OH-→NH3↑+H2O;由于滤液中还含有一定量的碳酸氢钠,故此加石灰水前先加热,是为防止加石灰水时产生碳酸钙沉淀;6)假设加热前纯碱的质量为m1,加热后的质量为m2,则加热损失的质量为:m1-m2,则纯碱中碳酸氢钠的质量为:84(m1-m2)/31;故纯碱中含有的碳酸氢钠的质量分数为: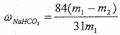 。
。
答案:1)Ca(OH)2或CaO;Na2CO3;

 w_w w. k#s5_
w_w w. k#s5_
2)溶解;过滤;蒸发;过滤;
3)有晶体析出(或出现浑浊);碳酸钠溶解度比碳酸氢钠大;
4)NH4Cl;取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子;
5)NH4++OH-→NH3↑+H2O;防止加石灰水时产生碳酸钙沉淀;
6)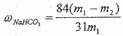 。
。
15.(2010年上海)CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
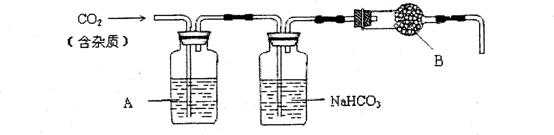
完成下列填空:
1)用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol.L-1),应选用的仪器是 。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
2)上述装置中,A是 溶液,NaHCO3溶液可以吸收 。
3)上述装置中,B物质是 。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果 (填“偏高”、“偏低”或“不受影响”)。
4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是 。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d .正已烷
5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出 后溶出 。
6)上述测定实验中,连续 ,说明样品已经恒重。

 w_w w. k#s5_
w_w w. k#s5_
解析:本题主要考查了溶液的配制、气体的除杂、实验设计和评价、蒸发等化学实验知识。1)配制一定体积比的溶液时,应选用烧杯、玻璃棒和量筒;2)根据实验所用药品,制得的气体中可能含有H2S、HCl和水蒸气;根据除杂的要求,除去H2S是可选用CuSO4溶液或酸性KMnO4溶液;碳酸氢钠溶液用于吸收HCl气体或吸收酸性气体;3)B物质用于干燥制得的CO2,可选用无水CaCl2;若失效,会导致CO2中混有水蒸气,从而造成测定结果偏低;4)根据石蜡和碳酸钙的有关性质,可选用稀醋酸溶出碳酸钙、正己烷溶出石蜡;5)由于醋酸中的乙酸也是有机物,为防止石蜡损失,一般先溶出石蜡再溶出CaCO3;6)根据实验数据的要求,称重时,当两次称量的结果相差不超过(或小于)0.001g,说明达到恒重。
答案:1)abc;

 w_w w. k#s5_
w_w w. k#s5_
2)CuSO4溶液或酸性KMnO4溶液;吸收HCl气体或吸收酸性气体;
3)无水CaCl2;偏低;
4)bd;
5)石蜡;CaCO3;
6)两次称量的结果相差不超过(或小于)0.001g。
14.(2010年广东)某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH = ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为________________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl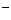 、OH
、OH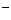 和SO
和SO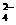 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
① 提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO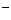 ;假设3:_____________.
;假设3:_____________.
② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
|
实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
 |
|
步骤2: |
|
|
步骤3: |
|
解析:(1) SO2是亚硫酸对应的酸酐,当NaOH过量时,生成的是正盐,反应的方程式为:SO2+2NaOH =Na2SO3+H2O。
(2)从方程式中前后元素的价态变化可以看出,S元素的价态从+4→+6,失去电子表现为还原性,故还原剂为Na2SO3。
(3)①很明显,假设3两种离子都存在。
②根据两种离子的性质可以鉴别。SO32-、ClO-分别具有还原性和氧化性,所以加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;在A试管中滴加紫色石蕊试液,若先变红后退色,证明有ClO-,否则无;在B试管中滴加0.01mol L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
答案:(1) Na2SO3+H2O;(2) Na2SO3;(3) ①SO32-、ClO-都存在
②

 w_w w. k#s5_
w_w w. k#s5_
|
实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |
 |
|
步骤2:在A试管中滴加紫色石蕊试液 |
若先变红后退色,证明有ClO-,否则无 |
步骤3:在B试管中滴加0.01mol L-1KMnO4溶液 L-1KMnO4溶液 |
若紫红色退去,证明有SO32-,否则无 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com