
题目列表(包括答案和解析)
15.环境监测测定水中溶解O2的方法是:量取a mL水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子,振荡混合摇匀。开塞,迅速加入适量的硫酸,此时有I2生成。用Na2S2O3溶液(b mol/L)和I2反应消耗V mL(以淀粉为指示剂),有关反应的离子方程式为:2Mn2++O2+4OH-¾®2MnO(OH)2(快),MnO(OH)2+2I-+2H+
¾®Mn2++I2+3H2O,I2+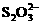 ¾®2I-+
¾®2I-+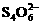 ,则水中溶解氧量(单位是mg/L)为
,则水中溶解氧量(单位是mg/L)为
A.8000Vb/a B.16000Vb/a C.8000ab/V D.16000ab/V
14.在O2中燃烧0.22 g由Fe和S元素组成的化合物,使其中的S全部转化为SO2,把这些SO2全部氧化生成SO3并转化为H2SO4,这些硫酸可被10 mL 0.5 mol/L的NaOH溶液完全中和,则原化合物中硫元素的质量分数为
A.72% B.40% C.36% D.18%
13.甲烷和氢气的混合气体5 g,充分燃烧后将生成的CO2通入澄清的石灰水中,石灰水增重11 g。求燃烧生成水的质量。18 g。
12.金属锡(Sn)的纯度可以通过下述方法分析:将试样溶于盐酸(Sn+2HCl ¾® SnCl2+H2),再加入过量FeCl3溶液(SnCl2+2FeCl3¾®SnCl4+2FeCl2),最后用已知浓度的K2Cr2O7溶液滴定生成的Fe2+离子(6FeCl2+K2Cr2O7+14HCl¾®6FeCl3+2CrCl3+2KCl+7H2O)。现有金属锡试样0.613 g,经上式各步反应后,共用去0.100 mol/L K2Cr2O7溶液16.0 mL,试求试样中锡的质量分数(假定杂质不参加反应)。93.1%。
根据变化的物质的量之间的关系写出物质之间发生反应的关系式。
11.让足量浓硫酸与10 g 氯化钠和氯化镁的混合物加强热反应,把生成的氯化氢溶于适量水中,加入二氧化锰使盐酸完全氧化,将反应生成的氯气通入KI溶液中,得到11.6 g碘,试计算混合物中氯的质量分数。65.2%。
10.工业上用NH3、空气和水作原料,合成化肥硝酸铵100 t。
(1)需要NH3多少吨?空气中的氧气多少吨?水多少吨?42.5 t,80 t,0 t。
(2)若NH3制NO转化率为96%,NO制HNO3转化率为92%,需要NH3多少吨?
根据多步反应中各物质化学反应中化学计量系数进行递推找对应关系式。 45.3 t。
9.含SiO2的黄铁矿试样1 g,在O2中充分灼烧后残余固体为0.76 g,用这种黄铁矿100 t可制得98%的浓硫酸多少吨?(设反应过程有2%的硫损失)117.6 t。
8. 准确称取6
g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL硫酸溶液的烧杯中,充分反应后,过滤,向滤液中加入10 mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示。
m/g 85%,12%,3%。1.625~5
准确称取6
g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL硫酸溶液的烧杯中,充分反应后,过滤,向滤液中加入10 mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积关系如图所示。
m/g 85%,12%,3%。1.625~5





 (1)硫酸溶液的物质的量浓度是_____mol/L。
b
1.75
(1)硫酸溶液的物质的量浓度是_____mol/L。
b
1.75
(2)若a=2.3,Fe(OH)3消耗碱液的体积是_____mL。 2.7
铝土矿中各成分的质量分数依次是_______________。 0 a 35 45 V/mL
(3)a值的范围在__________之间,在该范围内,a值越大,_____含量越少。Fe2O3
根据纵向多步反应中心元素守恒找对应关系式。
7.某气态有机物在标准状况下密度为1.34 g/L,取1.50 g该有机物在足量的氧气中燃烧。将所得气体通过装有浓硫酸的洗气瓶后再通过碱石灰干燥管,结果洗气瓶和干燥管分别增重0.9 g和2.2 g,测得尾气中除氧气外无其它物质,求该有机物分子式。CH2O
6.23.04 g Ca(OH)2、CaCO3、CaO、CaSO3固体混合物恰好和189.8 g 10%的盐酸溶液反应,反应后溶液重206.16 g,则所得溶液溶质的质量分数是_____%。14%。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com