
题目列表(包括答案和解析)
3、将5.000gNaCl、NaBr、CaCl2的混合物溶于水,通入氯气充分反应,然后把溶液蒸干并灼烧,得残留物4.914g。灼烧后的残留物再溶于水,并加足量的Na2CO3溶液,所得沉淀经干燥后质量为0.270g。求混合物中各化合物的质量百分组成。
分析:根据题意可列出下图示,帮助审清题意,找出思路和解法。
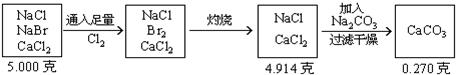
根据图示可分析:
(1)CaCO3的质量为0.270g,由它可求出CaCl2的质量。
 --
-- 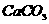
111 100
x克 0.270
x=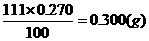
(2)混合物中通入Cl2
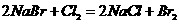 质量减少
质量减少
103 58.5 103-58.5=44.5(g)
y克 5.000-4.914=0.086(g)
y=0.200(g)
(3)NaCl的质量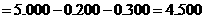 (g)
(g)
(4)各组分的百分含量
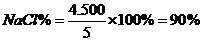
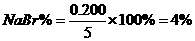
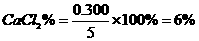
2、在100mL 36.5%的浓盐酸(密度为1. 18g/cm3)中加入多少mL 2mol/L的稀盐酸(密度为1.08g/cm3),才能配成6mol/L的盐酸(密度为1.10g/cm3)。
解析:任何溶液在稀释时,溶液和溶剂的量都要发生变化,但溶质的量不变,据此可以得到稀释下列各种浓度的溶液计算公式。
百分比浓度溶液的稀释公式:
浓溶液的质量×浓溶液的浓度 = 稀溶液的质量×稀溶液的浓度
mol尔浓度的溶液稀释公式:
浓溶液的浓度×浓溶液的体积(L) = 稀溶液的浓度×稀溶液的体积
同一溶质的两种不同浓度的溶液混合时,混合溶液的浓度介于溶液之间,混合液跟两原溶液中溶质、溶液量的基本关系是:
(1)混合液中所含溶质的总量等于两原溶液的溶质质量之和。
(2)混合溶液的质量等于两原溶液的质量之和,但体积不等于两原溶液的体积之和(当两原溶液很稀时,通常把混合液的体积近似地看做两原溶液的体积之和。)
在应用上述关系进行复杂的混合溶液计算时,可先算出混合溶液的总质量和溶质的总质量,然后再求出混合溶液的浓度。
设需加入VmL 2mol/L的盐酸
混合液中溶质的总物质的量
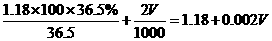
混合溶液的总体积:
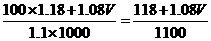
混合液的物质的量浓度:
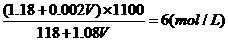
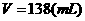
1、金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为:Sn+2HCl=SnCl2+H2↑再加入过量的FeCl3溶液,发生如下反应:SnCl2+2FeCl3=SnCl4+2FeCl2最后用已知浓度的K2Cr2O7溶液滴定生成Fe2+,反应的化学方程式为: 现有金属锡试样0.613g,经上述反应后,共用去0.100 mol/LK2Cr2O7溶液16.0mL。求试样中锡的百分含量(假定杂质不参加反应)。
现有金属锡试样0.613g,经上述反应后,共用去0.100 mol/LK2Cr2O7溶液16.0mL。求试样中锡的百分含量(假定杂质不参加反应)。
解析:该题是应用关系式法解多步反应的综合计算。根据题目所给出的三个化学反应,得出Sn与K2Cr2O7的物质量的关系。
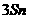 --
-- 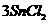 -- --
-- -- 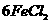 --
-- 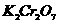
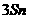 --
-- 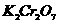
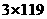 (g) 1mol
(g) 1mol
x
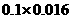 mol
mol
x=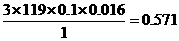 (g)
(g)
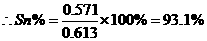
16.Cu2S-CuSO4+Cu(NO3)2,0.3 mol Cu(NO3)2中含N原子的物质的量是0.6 mol。
15.O2-4Na2S2O3,ax×10-3/32000=Vb×10-3/4,x=8000Vb/a。
14.S-H2SO4-2NaOH,x/32=0.5×0.01/2,x=0.08 g,S%=0.08/0.22=36%。
13.CH4+H2-CHx-CO2+(x/2)H2O,(12+x)/5=44/11=9x/y,x=8 g,y=18 g。
12.Sn-SnCl2-2FeCl2-K2Cr2O7/3,x/119=0.1×0.016×3,x=0.571 g,Sn%=0.571/0.613=93%
11.4HCl-Cl2-I2,11.6/254=x/146,x=6.7 g,Cl%=(6.7×35.5/36.5)/10=65.2%。
10.(1)2NH3+2O2-NH4NO3+H2O,x/34=y/64=100/80,x=42.5 t,y=80 t,不耗水。
(2)留下与HNO3反应的NH3没有损失,由(1)可知为42.5/2=21.25 t;
则另21.25 t NH3应理解为损失两次后的剩余量,即消耗NH3为:21.25/(96%×92%)=24.06 t;
共消耗NH3的质量为:24.06+21.25=45.31 t。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com