
题目列表(包括答案和解析)
6.实验探究题(18分)
Ⅰ.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题: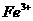 、
、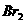 谁的氧化性更强?
谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性: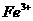 >
>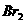 ,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
②乙同学认为氧化性: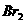 >
> 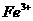 ,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为_▲_。
②在100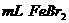 溶液中通入
溶液中通入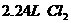 (标准状况),溶液中有1/3的Br-被氧化成单质
(标准状况),溶液中有1/3的Br-被氧化成单质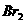 ,则原
,则原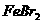 溶液中
溶液中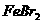 的物质的量浓度为_▲_。
的物质的量浓度为_▲_。
Ⅱ.某校化学实验兴趣小组为“证明某水煤气中CO2、CO 、H2 H2O(气)共同存在”。经讨论从以下提供的仪器和药品中设计组合成一套装置(假设其它杂质气体对本实验无干
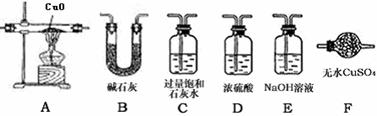 扰)
扰)
(1)该小组证明CO2存在应选用_▲_装置,现象是:_▲_。 证明H2O气的存在应选用_▲_装置,现象是:_▲_。
(2)若某些仪器可重复使用,某些仪器可不使用,B中反应完全进行,连接的玻璃导管、胶管忽略。按气流从左到右,用上述字母把各装置连接组合起来,正确的连接次序是: 混合气体-( )-( )-( B )-( )-( )-( )
(3)此实验的操作步骤中还有一欠缺之处,应如何改进?_▲_。
5.(8分)工业“从海水中提取镁”的流程图如下:
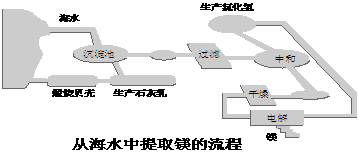
其步骤为:
① 将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
② 将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③ 在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④ 将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤ 电解熔融的氯化镁可得到Mg。
请回答以下问题:
⑴步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有 、 、酒精灯、铁架台等。
⑵步骤④中的“一定条件”指的是 ,目的是 。
⑶上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
。
⑷有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
你的观点是 。理由是
。
4、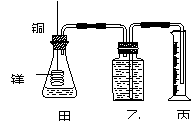 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如右图。该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如右图。该实验的主要操作步骤如下:
①配制浓度均为1 mol·L-1盐酸和醋酸溶液;
②用 量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③用精确的天平分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
⑴用文字表述④检查该装置气密性的操作与观察方法:
⑵本实验中应选用 (填序号)的量筒。 A.100 mL B.200 mL C.500 mL
⑶若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= 。
⑷简述速率不等的原因 ,铜丝不与酸接触的原因是 。
3.(9分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分别为:
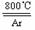 TiO2 +2C+2Cl2
TiO2 +2C+2Cl2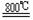 TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
TiCl4 +2CO ;TiCl4 +2Mg Ti +
2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:
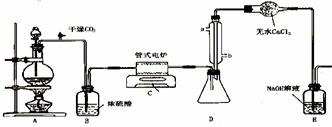
①连接好整套装置,在通Cl2前先从侧管中通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴ 正确的操作顺序为(填序号)___________________________ 。
⑵ 装置A中反应的离子方程式为__________________________________ 。
⑶ 装置D中冷凝管进水口的位置是(填a或b)___ 。
⑷ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑸ 工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,氩气的作用为__ 。
1.(13分)甲醛是世界卫生组织(WHO)确认的致癌物和致畸物质之一。我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛的含量,请你参与并协助他们完成相关学习任务。
[测定原理]KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。
4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O
2MnO4―+5H2C2O4+6H+=2Mn2++10CO2 ↑+8H2O
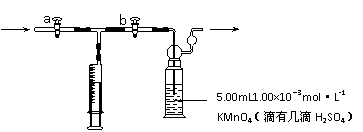 [测定装置]部分装置如下图所示
[测定装置]部分装置如下图所示
[测定步骤]
①用 量取5.00mL 1.00×10-3mol·L-1 KMnO4溶液于洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释备用。
②将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
③打开 ,关闭 (填“a”或“b”),用注射器抽取100mL新装修的房屋室内空气。关闭 ,打开 (填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次。
④将洗气瓶中溶液转移到锥形瓶中(包括洗涤液),再用标准草酸溶液进行滴定,记录滴定所消耗的草酸溶液的体积。
⑤再重复实验2次(每次所取的高锰酸钾溶液均为5.00mL)。3次实验所消耗草酸溶液的体积平均值为12.38mL。
[交流讨论]⑴计算该居室内空气中甲醛的浓度 mg·m-3,该居室的甲醛 (填是或否)超标。
⑵某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及滴定实验均无错误)提出合理假设:____________________________________ _(至少答出2种可能性)。
⑶实验结束后,该小组成员在相互交流的过程中一致认为:
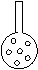 ①实验装置应加以改进。
①实验装置应加以改进。
有同学提议:可将插入KMnO4溶液的管子下端改成具有多孔的球泡(右图),
有利于提高实验的准确度,其理由是______ __
。
②实验原理可以简化。实验中无需用草酸标准液滴定,可直接抽取室内空气,再压送到洗气瓶中至KMnO4溶
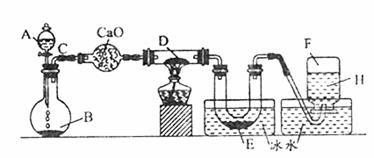 2.(8分)某一化学反应的实验装置如图所示:
2.(8分)某一化学反应的实验装置如图所示:
A-H属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氯水、水、锌粒、铜片、氯化钙、氧化钙、四氧化三铁、氧化铜、氢气、二氧化碳、二氧化氮、氯气、氯化氢、氨气、氮气、氧气。
实验现象:①D物质由黑色变为红色;②无水硫酸铜粉末放入无色透明的E中得到蓝色深夜;③点燃的镁条伸入无色无味的F中,镁条继续燃烧,将生成的物质放入水中,有气体放出,并有白色浑浊物形成,该气体具有刺激性气味,并能使润湿的红色石蕊试纸变蓝。通过分析回答:
|
A ;B ;D ;E ;F 。
(2)写出有关的化学方程式:A与B ;C与D ;F与Mg的反应产物与水 。
4.100 g原溶液¾分割®15 g H2O+84 g饱和溶液A+1 g溶质;
84 g 饱和溶液A¾分割®10 g H2O+70 g饱和溶液B+4 g溶质。
饱和溶液A中溶质为:84×4/14=24 g,故原溶液的质量分数为:25/100=25%。
3.x g 无水盐+100 g水¾分割®饱和溶液(25%)+H2O。
x/(x+100)=20%,x=25 g;25/(25+y)=25%,y=75 g。
2.140 g A盐溶液¾分割®40 g H2O+100 g饱和溶液B;40 g H2O+10 g A盐¾®50 g饱和溶液C。
由C可得B中有溶质20 g,20/140=14.3%。
1.50 g Na2SO3 7H2O¾分割®30 g Na2SO3饱和溶液+20 g Na2SO3固体。
m(Na2SO3)=50×126/252=25 g;饱和液中:m(Na2SO3)=25-20=5 g,S=5×100/(50-25)=20
5.Ag的价态降低,所以得到O2 0.5 mol,11.2 L;Fe的价态升高,所以得到NO 2/3 mol,14.9 L。
分割法巧解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com