
题目列表(包括答案和解析)
24.
Ⅰ.(1)化学方程式是 (1)4HNO3(浓)
 4NO2↑+O2↑+2H2O (2分)
4NO2↑+O2↑+2H2O (2分)
(2)不正确(1分),理由是带火星的木条熄灭可能是由于加热时产生大量水蒸气。 (2分)
Ⅱ.(1)该反应的化学方程式是2Cu(NO3)2  2CuO+4NO2↑+O2↑ (2分)
2CuO+4NO2↑+O2↑ (2分)
(2)正确(1分) ,理由是硝酸铜分解产生的混合气体中氧气的体积分数与空气中氧气的体积分数基本相同,若NO2不支持燃烧,则木条不会复燃。 (2分)
III.用金属铜与浓硝酸反应制取NO2气体,并用浓硫酸或无水氯化钙进行干燥,再将带火星的木条伸入二氧化氮中观察现象。(4分)
23、(1)A、F、D、C、E、B (2)吸收三氧化硫并放出等物质的量的二氧化硫
(3)干燥二氧化硫和氧气;(4)短进出口长出
(5) O2 、 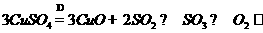
(6) BE
21..(12分)⑴如果是亚铁离子干扰,不可能变红之后,一段时间之后变成蓝色
⑵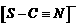
⑶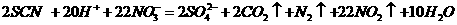
⑷比较硫氰根离子与氯离子、溴离子、碘离子的还原性强弱
⑸a、加入氧化剂如氯气等必须少量 b、不一定
22 ⑴只要写出下列4个离子方程式中的任意一个,即可。

 HCO-3+OH- CO2-3+H2O;Ca2++CO32-+OH- CaCO3↓+H2O;
HCO-3+OH- CO2-3+H2O;Ca2++CO32-+OH- CaCO3↓+H2O;
 Ca2++2HCO-3+2OH- CaCO3↓+CO32-+2H2O;
Ca2++2HCO-3+2OH- CaCO3↓+CO32-+2H2O;
 Mg2++2OH- Mg(OH)2↓
Mg2++2OH- Mg(OH)2↓
⑵③;Fe(OH)3 ⑶除去钙离子;调节溶液酸度
⑷杀菌消毒或氧化性 ⑸①
20. (20分)
(20分)
(Ⅰ)(1) (2分)
(2)①②③④ (2分) (3)能 (1分) (4) 烧杯内的溶液变红(1分)
(5)气球逐渐变大(1分);极易溶于水(1分)
(Ⅱ)(1)3:1 (2分)
(2)无色气体变为红棕色气体(1分),试管中液面不断上升至全充满(1分),继续通入氧气后,试管中液面下降(1分),最后充满无色气体(1分)。[2NO+O2=2NO2(1分) 3NO2+H2O=2HNO3+NO (1分)]或 4NO+3O2+2H2O=4HNO3 (2分)(3)1.375a (2分) a/11200(2分)
19. (共15分)
⑴ CN-+ClO-CNO-+Cl-
2CNO-+2H+ +3ClO-N2↑+2CO2↑+3Cl-+H2O
⑵ 除去HCl气体 去除Cl2 防止空气中CO2进入戊中影响测定准确度
⑶ 82%
①装置乙、丙、丁中可能滞留有CO2;
②CO2产生的速度较快未与戊中的澄清石灰水充分反应 ;
③Cl2、HCl在丙、丁中未吸收完全。
(三点中任意答两点即可,每答对一点给1分,共2分)
建议一:不将甲中溶液一次全部加入乙中,改为分次加入,控制CO2的产生速度;
建议二:乙中瓶塞改为三孔塞,增加的那个孔中插入一根导管到液面以下,反应结束后缓缓通入除去CO2的空气,使装置中滞留的CO2尽可能多的与Ca(OH)2反应。
建议三:将戊中澄清石灰水改为浓度较大的NaOH溶液,反应结束后向戊中加入足量CaCl2后测沉淀质量。等等
(三点中任意答一点即可) (每空2分,共15分)
18.(11分)⑴ 稀盐酸 KSCN溶液 2Fe2++Cl2=2Fe3++2Cl-
Fe3++SCN-=[Fe(SCN)]2+ (每空1分)
⑵ 少量的Fe2+转化为Fe3+,加入KSCN后显红色
4Fe(OH)2+2H2O+O2=4Fe(OH)3 (每空2分)
⑶ 不合理 我的猜想是[Fe(SCN)]2+离子中的SCN-被过量的氯水氧化。设计的实验为在褪色后溶液加入FeCl3溶液,仍不变红色(或在褪色后溶液加入加入KSCN溶液,变红色)
(第1空1分,第2空2分)
17.(1)①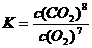 (1分)A、B、C(各1分,共3分)
(1分)A、B、C(各1分,共3分)
②NaA1O2[或NaA1(OH)4]、NaSiO3(各1分,共2分)
③除去A1O2、SiO32-等杂质(1分)
④2CrO42-+2H+=Cr2O72-+H2O(2分)
(2)(6分)
|
② |
蒸发 |
将所得溶液转移至蒸发皿中,加热蒸发溶液,使NaC1结晶析出 |
|
③ |
过滤 |
趁热过滤,将NaC1晶体与溶液分离 |
|
④ |
冷却,结晶 |
冷却滤液使K2Cr2O7结晶析出 |
16.(略)
15.(16分)
实验I:检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4)(2分)
实验II:①氢氧化铁胶体(或胶体)(1分);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色,有气泡产生(3分);Fe3++3SCN-=Fe(SCN)3(1分);Ba2++SO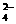 =BaSO4↓(1分)。②Fe3+与SO
=BaSO4↓(1分)。②Fe3+与SO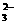 同时发生氧化还原反应和双水解反应(2分)
同时发生氧化还原反应和双水解反应(2分)
实验III:2Fe3++3CO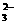 +3H2O=2Fe(OH)3↓+3CO2↑(2分)
+3H2O=2Fe(OH)3↓+3CO2↑(2分)
①SO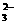 有较强的还原性,CO
有较强的还原性,CO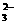 没有还原性(2分);②SO
没有还原性(2分);②SO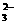 水解能力较CO
水解能力较CO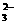 小(2分)。
小(2分)。
14. (14分)(1)DE(全对给4分) (2)AB(全对给4分)
(3)A(2分) (4)A(2分) (5)可防止倒吸(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com