
题目列表(包括答案和解析)
1.⑴在实验室进行的下列实验中,有关仪器的下端必须插入液面以下的是 (填编号)。
①分馏石油时用的温度计 ②制备乙烯时用的温度计
③用水吸收溴化氢的导管口 ④用碱液吸收多余氯气的导管口
⑤制备H2的简易装置中加入稀硫酸用的长颈漏斗
⑥制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液用的胶头滴管
 ⑵中学化学中许多实验都要用到玻璃棒,但其作用可能不完全相同,玻璃棒通常有下列三种用途:①搅拌;②引流;③蘸取溶液。在“用NaOH溶液、Na2CO3溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得较纯净的食盐”的实验中玻璃棒的作用可能有 ______ (填写编号)。
⑵中学化学中许多实验都要用到玻璃棒,但其作用可能不完全相同,玻璃棒通常有下列三种用途:①搅拌;②引流;③蘸取溶液。在“用NaOH溶液、Na2CO3溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以获得较纯净的食盐”的实验中玻璃棒的作用可能有 ______ (填写编号)。
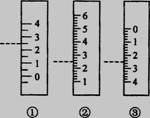
⑶右图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是__________。
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.5mL
D.②是温度计,读数是2.5℃
10、有6瓶白色同体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜、碳酸钠。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请填写下列空白:
(1)各取适量固体试剂分别加入6支试管中,加入适量蒸馏水,振荡试管。观察到的现象是
;
被l检出的物质的化学式(分子式)是 。
(2)分别取未检出的溶液,往其中加入上述已检出的溶液,观察到的现象和相应的离子方程式是
;
被检出的物质的化学式(分子式)是 。
(3)鉴别余下未检出物质的方法和观察到的现象是
。
9、钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO2)是目前最好的白色颜料。制备TiO2和Ti的原料是钛铁矿,我国的钛铁矿储量居世界首位。含有Fe2O3的钛铁矿(主要成分为FeTiO3)制取TiO2的流程如下:

(1)Ti的原子序数为22,Ti位于元素周期表中第__________周期,第 族。
(2)步骤①加Fe的目的是__________________________________________________;
步骤②冷却的目的是__________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是 ;考虑成本和废物综合利用因素,废液中应加入 处理。
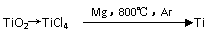 (4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
(4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
己知:①C (s)+O2 (g)=CO2 (g);△H=-393.5 kJ·mol-1
②2CO (g)+O2 (g)=2CO2 (g);△H=-566 kJ·mol-1
③TiO2(s)+2Cl2 (g)=TiCl4(s)+O2(g);△H=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO (g)的△H= 。
反应TiCl4+2Mg=2MgCl2+Ti在Ar气氛中进行的理由是
。
8.从固体物质A开始,可以发生如下框图所示的一系列变化:
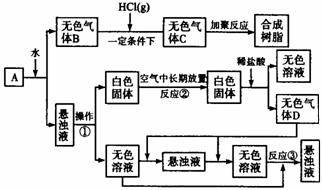
完成下面问题:
(1)在实验室中收集气体B的方法是 。
(2)操作①的名称是 。
在操作①中所使用的玻璃仪器的名称是 。
(3)写出反应②和反应③的化学方程式:
反应② ,
反应③ 。
(4)A的化学式是 。
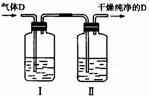
(5)在实验室中,如要获得干燥纯净的气体D,可以将它通过如上图所示的装置,其中瓶I中盛放的试剂是 ,瓶Ⅱ中盛放的试剂是 。
收集干燥气体D的方法是 。
7.已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
|
序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加入98%H2SO4,充分搅拌直到固体不再溶解 |
|
② |
 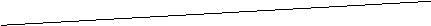 |
|
|
③ |
|
|
|
④ |
|
|
|
⑤ |
洗涤沉淀 |
|
|
⑥ |
检验沉淀 是否洗净 |
|
6.为了从海带(含有丰富的碘)中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是
(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是
。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法
。
5.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
|
③SiHCl3与过量H2在l000-1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为 。
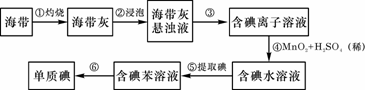
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
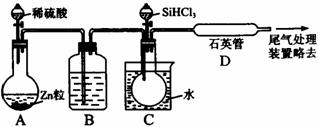
①装置B中的试剂是 。装置C中的烧瓶需要加热,其目的是
。
②反应一段时间后,装置D中观察到的现象是 ,
装置D不能采用普通玻璃管的原因是 ,
装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检验实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
4.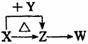 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如右图转化关系(部分反应物、产物及反应条件已略去)。
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如右图转化关系(部分反应物、产物及反应条件已略去)。
请回答:
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是
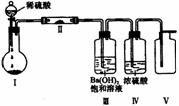 (3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
①装置Ⅱ中物质的化学式是 。
装置I中反应的化学方程式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是 ,所需仪器装置是
(从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成。该反应的化学方程式是 。
3.某研究小组进行与NH3有关的系列实验
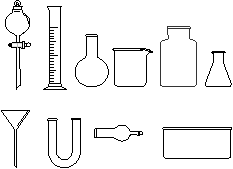
(1)从下图中挑选所需的仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。

 (2)将NH3通入溴水中,有N2生成,反应的化学方程式为
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为
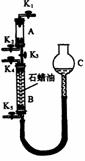
(3)为验证“同温同压下,相同体积的任何气体都含有相同数目的分子”,该小组同学设计了如右图所示的装置,图中B管的容积是A管的2倍,活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略;HCl和NH3均不溶于石蜡油,也不与之反应;)
①简述检验该装置气密性的方法
。
②在A管中充满与大气压强相等的干燥HCl气体,操作是
。
控制活塞K4、K5,调节C,使B管充满与A管同压的干燥NH3。
③缓慢开启活塞K3,A管中的现象是 。要达到实验目的,当反应完成并恢复到室温时,B管中预期的现象是 ;
若观察不到预期现象,主要原因是
。
2.氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,并计算产率,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
 (1)制备氧化铜
(1)制备氧化铜
工业CuSO4 CuSO4溶液 CuSO4·5H2O→……→CuO
①步骤I的目的是除不溶性杂质。操作是 。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是
。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是 ,过滤,水浴加热烘干。水浴加热的特点是 。
(2)探究氧化铜性质
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡。结论是 。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com