
题目列表(包括答案和解析)
20.(9分)在实验室中拟用氧化铜、稀硫酸、和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案。
甲:(1) CuO溶于适量稀硫酸中;
(2)在(1)的溶液中加入适量锌,充分反应后,过滤、烘干,即得纯净的铜。
乙:(1)锌与稀硫酸反应得氢气;
(2)将氢气通入氧化铜中并加热,充分反应后即得纯净的铜。
问:(1)若要制得相同质量的纯铜,甲乙所耗用的锌和稀硫酸是否相同?为什么?
(2)丙同学认为上述两种方案所制得的铜都难以保证铜的纯度,应对上述两种方案加以完善。你是否赞同丙同学的看法?为什么?你认为应怎样完善实验方案?
四、本题包括2小题,共16分。
21.( 6分)高温下,向1mol炽热的Cu2S中通入足量的水蒸气,生成2mol H2,同时还生成金属铜和一种有刺激性气味的气体。
(1)写出该反应的化学反应方程式___________________________________________。
(2)该反应中被氧化的元素是__________,被还原的元素是_____________。
(3)每生成1molH2,氧化剂与还原剂之间所转移电子的物质的量是_________mol。
19.(11分)(1)下列有关实验的叙述,正确的是(填标号)__________
A.用天平称取固体烧碱时,将NaOH固体放在垫有干净滤纸的托盘上
B.配制一定浓度的硫酸时,先往容量瓶中加水,然后按计算结果将一定体积浓硫酸沿玻璃棒慢慢倒入容量瓶,最后加水至刻度,摇匀
C.用分液漏斗进行分液操作,将甘油和水的混合液分离
D.用稀硝酸清洗做过银镜反应的试管
E.浓硫酸不慎溅在皮肤上,立即用稀NaOH溶液冲洗
(2)某学校化学课外小组用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
①应选择 作指示剂。
②为减小滴定误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是 (填选项字母)
A.1mol/L 50mL B.0.20mol/L 25mL
C.0.02mol/L 5mL D.5mol/L 10mL
③现有用浓盐酸新配制出的溶液,该盐酸在使用前,欲标定其准确的浓度,需用基准物进行标定。已知基准物是某些纯度高、稳定性好的物质,可在准确称量后直接配制成标准溶液并标定其它溶液的浓度。实验室标定标准的盐酸一般选用纯净的无水碳酸钠作基准物。
上述基准物能否改用纯净的氢氧化钠固体? (填“能”或“不能”);简述理由________________________________________________________。
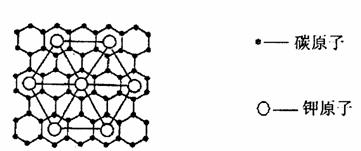
17、石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原了中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见右图,则x值为 ( )
A.8 B.12 C.24 D.60
18、把50 mL 2mol/L的NaOH溶液、100 mL 1mol/L的H2SO4溶液、以及40mL 3mol/L
的氨水混合,所得溶液能使酚酞试液呈浅红色,则溶液中离子浓度关系正确的是 ( )
A.c(SO42-)= c (Na+)> c(NH4+)> c(H+)> c(OH-)
B.c(NH4+)> c(SO42-) = c(Na+)> c(OH-) >c(H+)
C.c(Na+)> c(SO42-)> c(NH4+)> c(OH-)> c(H+)
D.c(Na+)+ c(NH4+)+ c(H+) = c(OH-) + c(SO42-)
第Ⅱ卷(非选择题,共78分)
三、本题包括2小题,共20分。
13、下列说法中正确的是(NA表示阿伏加德罗常数) ( )
A.通常状况下,11.2LCO2含有的分子数为0.5NA
B.标准状况下,44.8LSO2与22.4LO2在催化剂作用下反应,生成2NA个SO3
C.常温常压下,16g臭氧含有的氧原子数目为NA
D.2.3g金属钠变成离子时,失去的电子数目为NA
14、下列各组物质的溶液,不用其他试剂,也不用焰色反应就能将它们区别开来的是 ( )
A.AgNO3 NaCl BaCl2 NaOH
B.K2CO3 KHCO3 HCl H2SO4
C.Na2CO3 NaHSO4 Ba(NO3)2 KCl
D.KNO3 NaCl BaCl2 (NH4)2SO4
15、有机物分子中原子(或原子团)间的相互影响会导致化学性质的不同。下列叙述不能说明上述观点的是 ( )
(A)苯酚能与NaOH溶液反应,而乙醇不行
(B)丙酮(CH3COCH3)分子中的氢比乙烷分子中的氢更易被卤原子取代
(C)乙烯可发生加成反应,而乙烷不能
(D)相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多
16、右图所示为8000C时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是 ( )
A.A是反应物
B.前2 min A的分解速率为0.1 mol/(L•min)
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动
10、下列各组离子在碱性溶液中能大量共存,且无色透明,加酸酸化后溶液变色,但无沉淀、无气体生成的是 ( )
A.Fe2+、I-、ClO-、SO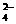 B.Br-、K+、SO
B.Br-、K+、SO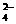 、BrO
、BrO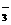
C.S2-、SO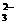 、K+、SO
、K+、SO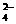 D.Ca2+、Cl-、H2PO
D.Ca2+、Cl-、H2PO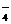 、Na+
、Na+
11、以M原子为中心形成的MX2Y2分子中,X、Y分别只以单键与M结合,下列说法正确的是 ( )
(A)若MX2Y2分子空间构型为平面四边形,则有两种同分异构体
(B)若MX2Y2分子空间构型为平面四边形,则无同分异构体
(C)若MX2Y2分子空间构型为四面体形,则有两种同分异构体
(D)若MX2Y2分子空间构型为四面体形,则无同分异构体
12、a,b,c,d,e是同周期的五种元素,比较a和b的最高价氧化物对应水化物碱性,是b的>a的;比较c和d的气态氢化物的还原性,是d的>c的;五种元素的原子得到或失去电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到达的顺序是 ( )
A.abdce B. baedc C. ebadc D. cdeab
6、已知S、Cr两元素的最高价均为+6价,则下列微粒中,从化合价分析,可能存在过氧键(-O-O-)的是 ( )
A. S2O72- B. S2O82- C. Cr2O72- D. CrO42-
7、200C时,将某盐R的溶液蒸发掉10g水后,恢复到200C,需再加入8g盐R(无结晶水),溶液即达饱和。若先加入2g盐R后再将盐溶液蒸发掉30g水,恢复到200C,溶液也达饱和。则200C时,盐R的溶解度是 ( )
A.20g B.25g C.30g D.60g
8、下列有关金属冶炼的说法中,不正确的是 ( )
A.用电解熔融三氧化二铝的方法得到活泼金属铝
B.直接利用热分解法加热铁矿石炼铁
C.用铝热反应原理炼得熔点较高的金属铬
D.利用热分解法直接加热HgO得到金属Hg
二、选择题(本题包括10小题,每小题4分, 17、18小题各5分,共42分,每小题有1个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2
分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9、联氨N2H4可用来除去高压锅炉中溶解的氧(N2H4+O2→N2+H2O未配平)有关叙述中正确的是 ( )
A.联氨分子中有非极性键 B.联氨分子中只有极性键
C.1kg联氨恰可除去1kg溶解氨 D.联氨在高压锅炉中可生成HNO3
5、下列实验事实可以用同一化学反应原理解释的是 ( )
A.乙烯与SO2都能使溴水褪色
B.氢氧化钠和纤维素都能与醋酸反应
C.烧碱和乙酸钠的溶液都能使酚酞试液变红
D.向乙醛和葡萄糖溶液中加入新制氢氧化铜,加热,都有砖红色沉淀产生
2、相同质量的两份醋酸分别与CH3CH218OH和CH3CH216OH在一定条件下反应,生成的酯的质量分别是a和b,则a、b关系正确是 ( )
A.a=b B.a<b C.a>b D.不能确定
3、下列事实中,不能用勒夏特列原理解释的是 ( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
4、以下说法中,能证明某无色透明的液体是纯水的是 ( )
A.测得该液体pH = 7
B.电解该液体得到H2和O2,且其体积比为2:1
C.向其中投入一小块金属钾,钾浮于液面剧烈滚动,发出咝咝的声音
D.在1.01×105 Pa压强下测得该液体的沸点为1000C
1、氨水中和纯碱溶液中的离子种类,前者与后者的关系是 ( )
A.大于 B.小于 C.等于 D.不能确定
16.(15分)甲是一种消毒剂,在一定条件下,经过以下转化,可制得水杨酸和苯酚。
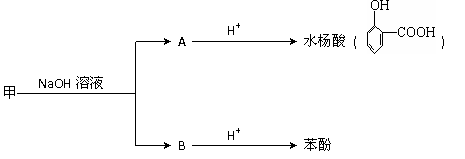

请回答下列问题:
(1)水杨酸的分子式是 。
(2)甲中含氧官能团的名称是 。
(3)苯环上有两个取代基,属于酯类的水杨酸的同分异构体有 种。
(4)写出甲在氢氧化钠溶液中发生反应的化学方程式
。
(5)用化学方程式说明水杨酸的酸性比苯酚的酸性强(药品可任选)。
。
(6)水杨酸有下列变化
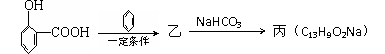

则乙的结构简式是 。
17(15分)煤是我国当今最主要的能源,又是十分重要的化工原料。煤的气化和液化是高效、清洁地利用煤的重要方法。该方法的化学反应主要是碳和水蒸气反应生成A、B的混合气体,然后再利用它们合成多种有机物。图16是某些物质的合成路线。A与B按不同比例反应可生成C、D、E。其中D是一种植物生长调节剂,用于催熟果实;F是一种无色、有刺激性气味的气体,是家庭装修常见污染物;C可分别与钠和银氨溶液反应。
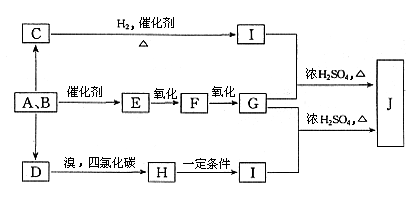
图16
(1)经测定,有机物J中碳、氢元素质量分数依次为40.68%、5.08%,其余为氧元素。J对H2的相对密度是59。
写出J的分子式______________
(2)写出下列物质的结构简式:
E______________,C______________。
(3)简述配制银氨溶液的操作:__________________________________________
____________________________________________________________________________
____________________________________________________________________________。
(4)写出下列化学反应方程式,并注明反应类型
G+I→J __________________________________________,______________。
D→H __________________________________________,______________。
(5)写出两种属于酯类,且与J互为同分异构体的结构简式
____________________________,____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com