
题目列表(包括答案和解析)
17.“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”。“烂版液”的主要成分是Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子。
在实验室中,由“烂版液”制取ZnSO4·7H2O的过程如下:
① 在“烂版液”中逐渐加入6mol·L-1NaOH溶液,至pH=8为止。
② 过滤后得到Zn(OH)2沉淀,用去离子水多次洗涤沉淀。
③ 用2mol·L-1的硫酸,慢慢将洗净的Zn(OH)2溶解,保持一定的pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
④ 溶液中注入2 mol·L-1的硫酸,使其pH保持为2……
⑴步骤①中控制溶液pH=8的操作是 ;步骤②中如何检验沉淀已经洗涤干净? 。
⑵步骤③中加热的目的是 ;趁热过滤的目的是 。
⑶将步骤④还缺少的操作是 ,所用的主要仪器是 。
16.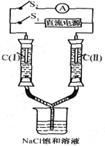 如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
如右图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液, C(Ⅰ)、c(Ⅱ)为多孔石墨电极。断开S2接通S1后,c(I)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转.说明此时该装置形成了原电池。关于该原电池的叙述正确的是
A.C(I)的电极名称是负极
B.C(Ⅱ)的电极名称是阳极
C.C(I)的电极反应式是2H++2e一=H2↑
D.C(Ⅱ)的电极反应式是Cl2 +2e一=2Cl一
第Ⅱ卷(非选择题 共86分)
15.下列各离子浓度的大小比较,正确的是 A.NH4+同浓度的下列溶液中:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,则溶液浓度由大到小的顺序是:②>③>①
B.由pH=3的HAc与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:
c(Ac-)>c(Na+)>c(H+)>c(OH-)
C.pH=13 Ba(OH)2与pH=1 HCl溶液等体积混合后,混合液的pH>7
D.将pH=12 Ba(OH)2与pH=14 NaOH溶液等体积混合后,混和液13<pH<14
14. 以水为溶剂进行中和滴定的原理是:H3O++OH-
以水为溶剂进行中和滴定的原理是:H3O++OH- 2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也能发生自电离:2SO2
SO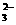 +SO2+;△H>0。下列叙述中,错误的是 ( )
+SO2+;△H>0。下列叙述中,错误的是 ( )
A.若以液态SO2为溶剂,用SOCl2滴定Na2SO3,该滴定反应可以表示为:
SO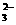 +SO2+
+SO2+ 2SO2
B.在一定温度下,液态SO2中c(SO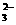 )与c(SO2+)的乘积是一个常数
)与c(SO2+)的乘积是一个常数
C.液态SO2中自电离的存在,说明SO2是离子化合物
D.适当升高温度,液态SO2的导电能力增强
13.某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:① 加入过量盐酸,有气体生成;② 在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。原溶液中一定存在的离子是
A.Al3+、Fe3+、SO42- B.Na+、AlO2-、CO32-
C.Na+、AlO2-、SO42-、CO32- D.Na+、Ba2+、AlO2-
12. 在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法正确的是
在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g)
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L-1。下列说法正确的是
A.4min时,M的转化率为80%
B.4min时,用M表示的反应速率为0.8mol·L-1·min-1
C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小
D.2min时,M的物质的量浓度为0.6mol·L-1
11.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O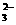 +O2+xOH-
+O2+xOH- Fe3O4+S4O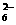 +2H2O,
+2H2O,
下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol B.Fe2+和S2O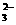 都是还原剂
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol D.x=2
10.某黄色溶液中可能含有下列离子:K+、NH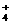 、Fe3+、Ba2+、SO
、Fe3+、Ba2+、SO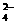 、HCO
、HCO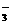 、Cl-、S2-,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是
、Cl-、S2-,为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是
A.溶液中存在大量Fe3+ B.溶液中可能存在大量Ba2+
C.溶液中不存在大量HCO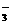 和S2- D.溶液可能呈强碱性
和S2- D.溶液可能呈强碱性
9.下列离子方程式中,正确的是
A.向Mg(HCO3)2溶液中加入过量的NaOH溶液
Mg2++2HCO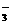 +4OH-
+4OH-
Mg(OH)2↓+2CO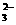 +2H2O
+2H2O
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO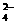 反应完全
反应完全
2Ba2++4OH-+Al3++2SO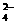
2BaSO↓+AlO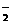 +2H2O
+2H2O
C.足量的CO2通入饱和碳酸钠溶液中:CO2+CO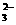 +H2O
+H2O 2HCO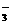
D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO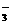
3Fe3++NO↑+2H2O
8.下列4组连线中,完全正确的一组是



 A.缺铁
会引起贫血
B.喝加钙奶
补充铁元素
A.缺铁
会引起贫血
B.喝加钙奶
补充铁元素

 缺钙 会得甲状腺肿大
食用碘盐 补充钙元素
缺钙 会得甲状腺肿大
食用碘盐 补充钙元素
缺碘 会得佝偻病 服补血口服液 补充碘元素


 C. 碘 抗癌之星 D.少吃油条 加醋后可长时间炖煮
C. 碘 抗癌之星 D.少吃油条 加醋后可长时间炖煮

 硒 智力之星 治疗胃酸过多 尽量不服用含Al(OH)3的胃舒平
硒 智力之星 治疗胃酸过多 尽量不服用含Al(OH)3的胃舒平
 氟 龋齿克星 使用铝锅
因油条中含有明矾
氟 龋齿克星 使用铝锅
因油条中含有明矾
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com