
题目列表(包括答案和解析)
23.
 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: NaCrO4¬¾¾¾¾¾NaCrO2
化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: NaCrO4¬¾¾¾¾¾NaCrO2
(1)在上述有编号的步骤中,需用还原剂的是: ⑤ ④ ③
_____,需用氧化剂的是:_____。 Na2Cr2O7¾① ®CrCl3¾② ®Cr(OH)3
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 __(填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
___Na2Cr2O7+___KI+___HCl¾®___CrCl3+___NaCl+___KCl+___I2+___ _____
26. NO2在加热条件下能够分解成NO和O2。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125 mol/L)。下图中的曲线表示NO2分解反应在前25秒内的反应进程。
NO2在加热条件下能够分解成NO和O2。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125 mol/L)。下图中的曲线表示NO2分解反应在前25秒内的反应进程。
(1)请计算前20秒内氧气的平均生成速度:__________
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加化剂后的反应进程曲线。
(4)写出该反应的化学平衡常数表达式:__________
2001年
25.有效地利用现有能源和开发新能源已受到各国的普遍重视。
可用改进汽油组成的办法来改善汽油的燃烧性能。例如,加入CH3OC(CH3)3来生产“无铅汽油”。
(1)CH3OC(CH3)3分子的结构式为_______________
(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一开然气常和石油伴生,其主要的成分是_____。能说明它是正四面体而非正方形平面结构的理由是________________________________
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50公里/小时行驶了40公里。为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济的制氢方法是_____
① 电解水 ② 锌和稀硫酸反应 ③ 光解海水
其次,制得纯氢气后还需要解决的问题是_____________________
24.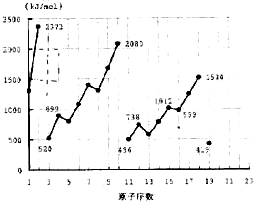 不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如右图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:____________________________
各主族中E值的这种变化特点体现了元素性质的__________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现试预测下列关系式中正确的是_____
A.198个 B.199个 C.200个 D.201个
① E(砷)>E(硒) ② E(砷)<E(硒) ③ E(溴)>E(硒) ④ E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:____<E<____
(4)10号元素E值较大的原因是___________________
23.KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为:
_____KClO3+___HCl(浓)¾®___KCl+___ClO2+___Cl2+___ _____
(1)请完成该化学方程式并配平(未知物化学式和系数填入横线上)。
(2)浓盐酸在反应中显示出来的性质是_____
① 只有还原性 ② 还原性和酸性 ③ 只有氧化性 ④ 氧化性和酸性
(3)产生0.1 mol Cl2,则转移的电子的物质的是为_____mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_____倍。
31.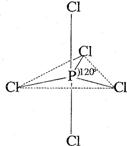 白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示。该结构中氯原子有两种不同位置。
白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PCl5为例)如右图所示。该结构中氯原子有两种不同位置。
(1)6.20g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为 L。上述燃烧产物溶于水配成50.0 mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为 mol/L。
(2)含0.300 mol H3PO4的水溶液滴加到含0.500 mol Ca(OH)2的悬浮液中,反应恰好完全,生成l种难溶盐和16.2 g H2O。该难溶盐的化学式可表示为
(3)白磷和氯、溴反应,生成混合卤化磷PCl5-xBr(0<x<5,且x为整数)。如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为
(4)磷腈化合物含有3种元素,且分子中原子总数小于20。0.10 mol PCl5和0.10 mol NH4Cl恰好完全反应,生成氯化氢和0.030 mol磷腈化合物。推算磷腈化合物的相对分子质量(提示:M>300)。
30.Na2SO3·7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na2SO3在30℃时的溶解度为35.5g/100gH2O。
(1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数 。(保留2位小数)
。(保留2位小数)
(2)计算30℃时271g Na2SO3饱和溶液中水的质量。
(3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3·7H2O晶体79.5g。计算10℃时Na2SO3在水中的溶解度。
31. 烟气中NOx是NO和NO2的混合物(不含N2O4)。
烟气中NOx是NO和NO2的混合物(不含N2O4)。
(1)根据废气排放标准,1 m3烟气最高允许含400 mg NOx。若NOx中NO质量分数为0.85,则1 m3烟气中最高允许含NO__________L(标准状况,保留2位小数)。
 (2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16
g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为__________mol/L(保留2位小数)。
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16
g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为__________mol/L(保留2位小数)。
(3)已知:NO+NO2+Na2CO3¾®2NaNO2+CO2 ①
 2NO2+Na2CO3¾®NaNO2+NaNO3+CO2 ②
2NO2+Na2CO3¾®NaNO2+NaNO3+CO2 ②
1 m3含2000 mg NOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气__________排放标准(填:符合、不符合),理由:______________________
 (4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3¾®3NO2+H2O
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3¾®3NO2+H2O
 当烟气中n(NO):n(NO2)=2:3时,吸收率最高。
当烟气中n(NO):n(NO2)=2:3时,吸收率最高。
1 m3烟气含2000 mg NOx,其中n(NO):n(NO2)=9:1。
 计算:(i)为了达到最高吸收率,1 m3烟气需用硝酸的物质的量(保留3位小数)。
计算:(i)为了达到最高吸收率,1 m3烟气需用硝酸的物质的量(保留3位小数)。
(ii)1 m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应 ① 比反应 ② 迅速。计算结果保留1位小数)。
2010年
30. 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2¾放 电®2O3。
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2¾放 电®2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为_____g/mol (保留一位小数)。
(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为______L。
 (3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6
g。则原混合气中臭氧的体积分数为_________。
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6
g。则原混合气中臭氧的体积分数为_________。
31.小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.50 g NaHCO3,2片小苏打片和胃酸完全中和,被中和的氢离子是_____mol。
(2)胃舒平每片含0.245 g Al(OH)3。中和胃酸是,6片小苏打片相当于胃舒平_____片。
(3)达喜的化学成分是铝和镁的碱式盐。
① 取该碱式盐3.01 g,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。
② 在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.74 g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。
2009年
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com