
题目列表(包括答案和解析)
5.比较合成氨工业与接触法制硫酸中SO2催化氧化的生产过程,下列说法错误的是 ( )
A.都使用了合适的催化剂
B.都选择了较高的温度
C.都采用了原料循环使用以提高原料利用率的方法
D.都采用了高压的生产条件
4.铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为 ( )
A.Fe(OH)3 ;Fe2O3 B.Fe(OH)2 ;FeO
C.Fe(OH)2、Fe(OH)3 ;Fe3O4 D.Fe2O3 ;Fe(OH)3
3.下列反应产生的气体,通过Na2SO3溶液不反应的是 ( )
①Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸 ④浓硝酸和铜片 ⑤铜片和浓硫酸共热 ⑥固体NaCl和浓H2SO4 ⑦FeS和稀硝酸 A..①② B.② C.①②⑤ D.全部反应
2.美国“9·11”恐怖袭击事件给纽约带来了一场严重的环境灾难--石棉污染,易使吸人石棉纤维者患肺癌,已知石棉是硅酸盐矿物,某种石棉的化学式可表示为Ca2MgxSiyO22(OH)2,则x、y的值分别为 ( )
A.8,3 B.5,8 C.3,8 D.5,5
1.人们把食品分为“绿色食品”、“蓝色食品”、“白色食品”等,绿色植物通过光合作用转化的食品叫做“绿色食品”,海洋提供的食品叫做“蓝色食品”,通过微生物发酵制得的食品叫做“白色食品”。下列物质属于“白色食品”的是 ( )
A.面粉 B.食醋 C.海带 D.菜油
18.(11分)工业上利用氨催化氧化法可制取硝酸,加入脱水剂后制得较高浓度的硝酸。现以17吨氨作为原料,假设NH3全部转化为HNO3。
(1)写出NH3完全转化为HNO3的总化学反应方程式
(2)生产过程中需加水吸收,如果加入脱水剂后脱去水的量相等,则所得硝酸溶液的质量分数为多少?
(3)如果生产中同时制得50%的硝酸m1吨和90%的硝酸m2吨(脱去的水可循环使用,制得教低浓度的稀硝酸),若共加入27吨水,则m1与m2的质量比为多少?
17.(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。为完成测定并验证有NO生成,有人设计下图实验装置。
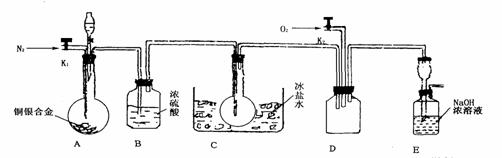
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是_____________________________________________________________。
(2)装置B瓶的作用是__________________________________________________。
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人_______________(填“冷”或“热”)的氧气。
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是____________________________________________________________________。
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1。实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________。
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程________________________。
16.(8分)已知甲、乙、丙是三种常见的单质,且组成它们的元素核电荷数之和为35;A-G是七种常见化合物:上述各物质间的相互转化关系如下图所示(反应条件和其它生成物略)。
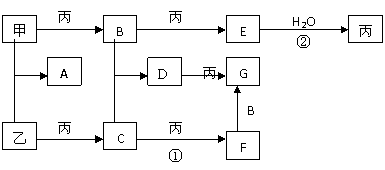
试回答:
(1)B的化学式是:______ ,D的名称是_________ ;
(2) 写出①、②两步变化的化学方程式:
15.(6分)有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、NO3- 、Cl-、I-,取该溶液进行如下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
⑶取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的上述离子有 ,肯定不存在的上述离子有 ,还不能确定是否存在的上述离子有 。
14.(7分)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1) 写出一氧化碳与一氧化氮反应的化学方程式: 。
(2) “催化转化器”的缺点是在一定程度上提高空气的酸度,其原因是
。
(3) 控制城市污染源的方法可以有 (多选扣分)
A. 开发氢能源 B. 使用电动车 C. 植树造林 D. 戴上呼吸面具
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com