
题目列表(包括答案和解析)
3.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④敞口放置的久置氯水
⑤盐酸 ⑥用盐酸酸化的漂白粉溶液
A.①②③
B.①②③⑥
C.③⑥
D.③④⑥
2.(2009年全国卷Ⅰ)下列表示溶液中发生反应的化学方程式错误的是( )
A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B.2KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
C.MnO2+4HCl(浓)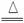 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
1.自来水厂常使用氯气消毒,市场上有些小商贩用自来水充当纯净水出售。下列试剂中可用来辨别纯净水真伪的是( )
A.酚酞试液
B.氯化钡溶液
C.氢氧化钠溶液
D.硝酸银溶液
12.(2009年山东模拟)某化学兴趣小组在探究卤素单质的氧化性的实验中发现,在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。原因是什么?Br2能否氧化Fe2+,Fe3+与Br2谁的氧化性更强?
(1)甲同学认为:Br2不能氧化Fe2+,Fe3+的氧化性大于Br2,产生上述现象的原因不是因化学反应所致,溶液呈黄色是含____________(填化学式,下同)所致。
(2)乙同学认为:Br2将Fe2+氧化为Fe3+,Fe3+的氧化性小于Br2,产生上述现象的原因是因化学反应所致,则溶液呈黄色是含____________所致。
(3)丙同学为验证乙同学的观点,选择下列试剂,设计出两种方案进行实验,并通过观察实验现象,证明了乙同学观点是正确的。供选用的试剂:a.酚酞试剂;b.CCl4;c.无水酒精;d.KSCN溶液。请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)氧化性:Br2>Fe3+。故在FeCl2中滴入1~2滴溴水,溶液呈黄色。发生反应的离子方程式是_____________________ 。
(5)根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是____________。在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度是____________________。
11.(2010年潍坊模拟)海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。如下图是某工厂对海水资源进行综合利用的示意图。
回答下列问题:
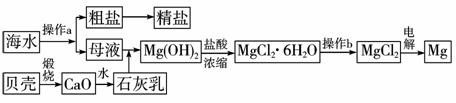
(1)流程图中操作a的名称为____________。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。气体A、B是CO2或NH3,则气体A应是____________(填化学式)。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:____________ 。
②操作b是在____________气氛中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式___________________ 。
③工业制取镁不采用电解MgO,其原因是______________________ 。
10.在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用如图工艺流程生产单质碘:
试回答:
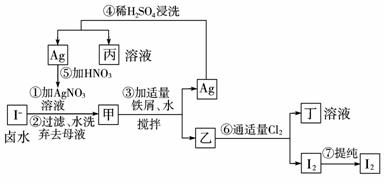
(1)乙、丁中溶质的化学式:乙____________;丁____________。
(2)第④步操作中用稀H2SO4浸洗的目的是____________(填写字母编号)。
a.除去未反应的NO3- b.除去未反应的I-
c.除去未反应的Fe d.除去碱性物质
(3)第⑦步操作可供提纯I2的两种方法是____________和____________(不要求写具体步骤)。
(4)实验室检验I2的方法是____________ 。
(5)甲物质见光易变黑,其原因是(用化学方程式表示)____________ 。
9.目前,从海水中提取的溴约占世界溴产量的1/3。常用的一种海水提取溴的技术叫做吹出法,操作如下:(1)氯化:在浓缩的海水中通入氯气,置换出海水中的溴离子,使之成为溴单质,相关的离子
方程式为:_________________,
其中的氧化剂是______________,
氧化产物是_______________。
(2)吹出:在上述反应后的溶液中吹入水蒸气,则生成的溴单质从溶液中逸出,说明溴单质具有____________性,在水中的溶解度____________。
(3)吸收:吹出的溴单质进入有二氧化硫的吸收塔,使水蒸气、溴蒸气与二氧化硫反应生成硫酸与氢溴酸,从而达到溴富集的目的,再用氯气将氢溴酸氧化,即得到产品溴。请写出
相关反应的化学方程式:____________ 。
工业上,若生产160吨溴单质,需要SO2的体积为____________L(标准状况下),同时可生产98%的H2SO4____________t。
8.向NaBr、NaI、Na2SO3的混合溶液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A.NaCl、Na2SO4
B.NaCl、NaBr、Na2SO4
C.NaCl、Na2SO4、I2
D.NaCl、Br2、Na2SO4
7.氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl2相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H2O=HBrO+HCl,下列有关BrCl
的性质的叙述中不正确的是( )
A.是较强的氧化剂
B.Br的化合价为-1价
C.能使湿润的碘化钾淀粉试纸变蓝
D.BrCl与水反应中,BrCl既是氧化剂又是还原剂
6.下表是氧化镁和氯化镁的熔沸点数据:
|
物质 |
氧化镁 |
氯化镁 |
|
熔点/℃ |
2852 |
714 |
|
沸点/℃ |
3600 |
1412 |
请参考以上数据分析,从海水中提取镁,正确的方法是( )
A.海水 Mg(OH)2
Mg(OH)2
 Mg
Mg
B.海水 MgCl2溶液MgCl2(熔融)
MgCl2溶液MgCl2(熔融) Mg
Mg
C.海水 Mg(OH)2
Mg(OH)2 MgO
MgO Mg
Mg
D.海水 Mg(OH)2
Mg(OH)2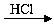 MgCl2溶液→MgCl2(熔融)
MgCl2溶液→MgCl2(熔融) Mg
Mg
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com