
题目列表(包括答案和解析)
21.硫化物通常有“废物”之称。因硫化物据其溶解性可以分三类:①易溶于水的只有K2S,Na2S,(NH4)2S;②易溶于强无氧化性酸,不溶于水的仅有FeS,ZnS;③大部分的硫化物既不溶于水也不溶于无氧化性强酸,如HgS,Ag2S,CuS,Cu2S。其中,Ag2S,CuS,Cu2S能溶于硝酸发生氧化还原反应,而HgS只能溶于王水(硝酸与盐酸的混合液)。
氢硫酸溶液中存在下列平衡:H2S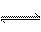 H++HS-,HS-
H++HS-,HS- H++S2-.
H++S2-.
(1)推测硫化氢通入硫酸铜溶液中生成硫酸的原因是 ;
(2)在氢硫酸溶液中改变下列条件,使溶液中c(OH-),c(S2-)都增大的是( )
A.加入少量的漂白精 B.通入氨气
C.通入少量过氧化钠粉末 D.加入少量硝酸银溶液
(3)难溶电解质在水溶液里存在着溶解平衡,在常温下,溶液中各离子浓度以它们的系数方次的乘积在一定温度下是一个常数,该常数叫溶度积(Ksp)。例如,
Cu(OH)2 Cu2++2OH-,Ksp=c(Cu2+)[c(OH-)]2=2×10-20.已知在常温下,FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与c(S2-)之间存在如下关系:c(H+)2·c(S2-)=1.0×10-22.在该温度下,将适量FeS投入硫化氢饱和溶液中,欲使溶液c(Fe2+)中达到1mol/L,应调节溶液的c(H+)为 。
Cu2++2OH-,Ksp=c(Cu2+)[c(OH-)]2=2×10-20.已知在常温下,FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与c(S2-)之间存在如下关系:c(H+)2·c(S2-)=1.0×10-22.在该温度下,将适量FeS投入硫化氢饱和溶液中,欲使溶液c(Fe2+)中达到1mol/L,应调节溶液的c(H+)为 。
20.某溶液中只含有Na+、H+、OH-、CH3COO-四种离子,某同学推测其离子浓度的大小顺序有如下四种关系:
①c(Na+)>c (CH3COO-)>c(OH-)>c(H+)
②c(Na+)>c (CH3COO-) >c(H+)>c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度大小顺序为 (填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为
(3)若该溶液是由体积相等的氢氧化钠和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)(填大于、小于或等于,下同),混合前酸中的H+ 和碱中的OH-大小关系是
c(H+) c(OH-)
19.现有常温下的0.1mol·L-1纯碱溶液。
⑴你认为该溶液呈碱性的原因是(用离子方程式表示): ; 为证明你的上述观点,请设计一个简单的实验,简述实验过程: 。
⑵同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。 。
⑶同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是
A.c(Na+)=2c(CO32-)
B.c(CO32-)>c(OH-)>c(HCO3-)>c(H2CO3)
C.c(CO32-)+c(HCO3-)=0.1mol·L-1
D.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
⑷水解反应是典型的可逆反应。水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式: 。
18.美国科学家鲍林在研究含氧酸的强弱时,提出了一个定性判断的经验规律,即含氧酸分子中的非羟基氧原子数与酸的强弱成相关性。设含氧酸化学式为HnROm,则非羟基氧原子数为(m-n),其数值越大,该含氧酸越强。
|
m-n |
0 |
1 |
2 |
3 |
|
含氧酸强度 |
弱酸 |
中强酸 |
强酸 |
最强酸 |
|
实例 |
HClO |
H3PO3 |
HNO3 |
HClO4 |
已知亚磷酸(H3PO3)是中强酸,H3AsO3(亚砷酸)既有弱酸性又有弱碱性。
(1)写出在亚磷酸溶液中加入过量氢氧化溶液反应的离子方程式: ;
(2)写出在H3PO3和H3AsO3中分别加入盐酸,能反应的写出化学程式: ;
(3)在亚磷酸溶液中滴加硝酸银溶液,有黑色沉淀银生成及无色气体放出,写出此反应的化学方程式: ;
(4)该鲍林规则只是经验性的,有些例外,举一例: 。
17.酸碱中和滴定、一定物质的量浓度溶液的配制实验等是中学化学中重要的定量实验。
(1)配制一定物质的量浓度溶液时,容量瓶在使用前需检漏,应如何操作? ;
 (2)中和反应都是放热反应,测定“0.50mol/L50mL盐酸和0.55mol/L50mL氢氧化钠溶液反应放出的热量”,将两溶液混合时应将两溶液一次性全部混合,不能逐滴加入,这样操作的目的是
;
(2)中和反应都是放热反应,测定“0.50mol/L50mL盐酸和0.55mol/L50mL氢氧化钠溶液反应放出的热量”,将两溶液混合时应将两溶液一次性全部混合,不能逐滴加入,这样操作的目的是
;
(3)如图是三种定量仪器的一部分,在酸碱中和滴定
时应选用,在滴定接近终点时,应用蒸馏水圈
洗锥形瓶内壁,目的是 。
16.炼金废水中含有络离子[Au(CN)2]+,其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强.回答下列问题:
(1)HCN的电离方程式为 ,NaCN溶液pH 7(填大于,小于或等于) (2)与弱酸电离方式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为 ;
(3)处理这种废水时是在碱性条件下,NaClO将CN-氧化为CO32-和N2.其离子方程式为 ;
(4)在酸性条件下,NaClO也能氧化CN-,但实际处理废水时却不要酸性条件下进行的主要原因是 .
15.金属离子和硫离子在水溶液中的反应比较复杂,其产物与溶液的酸碱性,金属硫化物的溶解性与金属离子的性质等因素有关.查阅资料表明:CuS的溶解度很小,在稀酸溶液中也不溶解,Fe2S3的溶解度更小,但能溶于稀酸.下列有关说法正确的是 ( )
A.Cu2+和S2-在水溶液中反应的产物是Cu2S
B.Al3+和S2-在水溶液中反应是Al2S3
C.Fe3+和S2-在酸性溶液中反应的产物是Fe2+,S和H2S
D.在酸性溶液中,S2-还原Fe3+的能力比还原Cu2+强
14.下列说法正确的是 ( )
A.电解质溶液的浓度越大,其导电能力一定越强
B.强酸和强碱一定是强电解质,不管其水溶液浓度的大小,均能完全电离
C.强极性共价化合物不一定都是强电解质
D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强
13.下列各组离子,在指定环境中能大量共存的是 ( )
A.在AG=lg[c(H+)/c(OH-)]>1的溶液中,Na+,S2-,K+,CO32-
B.在pH=1的溶液中,SO32-,S2O32-,NH4+,Na+
C.在AG=lg[c(H+)/c(OH-)]=-3的溶液中,Fe3+,Cu2+,NO3-,SO42-
D.在pH=0的溶液中,Fe3+,NO3-,Na+,Cl-
12.下列叙述正确的是 ( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com