
题目列表(包括答案和解析)
19.(12分)在一恒温恒容体积为1 L的容器中存在如下可逆反应:2NO2(g)  N2O4(g),已知:NO2、N2O4的消耗速率与本身浓度存在下列关系v(NO2) = k1·c(NO2)2,v(N2O4) = k2·c(N2O4) 其中k1、k2反应及温度有关的常数,可以根据上述关系式建立一个速率-浓度的图像如下
N2O4(g),已知:NO2、N2O4的消耗速率与本身浓度存在下列关系v(NO2) = k1·c(NO2)2,v(N2O4) = k2·c(N2O4) 其中k1、k2反应及温度有关的常数,可以根据上述关系式建立一个速率-浓度的图像如下

试回答下列问题
(1)图中的交点A对应该可逆反应的状态是否达到化学平衡状态?________(填“是”或“否”)作出判断的理由是__________________________________
(2)若k1 = k2,则在开始时向该容器中充入1 molNO2,则达到平衡时NO2的浓度为
________,N2O4的浓度为____________
(3)若k1≠k2,则在开始时向该容器中充入1 molNO2,设达到平衡时NO2的浓度为c1,N2O4的浓度为c2,则c1与c2的关系为____________,c1、c2、k1、k2存在的关系为_________
18.(8分)373K时,某1 L密闭容器中发生如下可逆反应A(g)  2B(g)。其中物质B的物质的量变化如图所示:
2B(g)。其中物质B的物质的量变化如图所示:
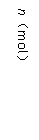
试填空:
(1)已知373K时60s达到平衡,则前60s内A的平均反应速率为 。
(2)若373K时B的平衡浓度为是A的3倍,473K时(其他条件不变),B的平衡浓度为A的2倍,请在上图中画出473K时A的物质的量随时间的变化曲线。
(3)若反应在373K进行,在1 L密闭容器中加入1 mol B、0.2 molHe,达到平衡时B的转化率应 。
A.等于60% B.等于40% C.小于40% D.介于40%-60%之间
(4)已知曲线上任意两点之间连线的斜率表示该时段内B的平均反应速率(例如直线EF的斜率表示20s~60s内B的平均反应速率),试猜想曲线上任意一点的切线斜率的意义 。
17.(8分)某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g);ΔH>0。反应中CO2的浓度随时间变化情况如下图:
CO2(g)+H2(g);ΔH>0。反应中CO2的浓度随时间变化情况如下图:
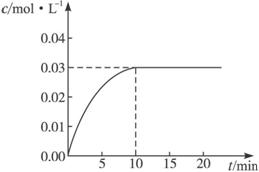
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为___________;反应达平衡时,c(H2) = ______________。
(2)判断该反应达到平衡的依据是_________。
①CO减少的化学反应速率和CO2减少的化学反应速率相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
④正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O) = _________。
16.(9分)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是___________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_____(填“增大”、“减小”、“不变”),原因是____________________________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响?___________,原因是______________
______________________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_______,E2_______(填“增大”、“减小”、“不变”)。
15.难挥发性二硫化钽(TaS2)可采用如下装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
TaS2(s)+2I2(g)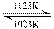 TaI4+S2(g) TaI4+S2(g)下列说法正确的是 |
 |
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
第Ⅱ卷(非选择题 共55分)
14.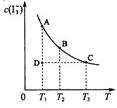 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)  I3-(aq)
I3-(aq)
某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的
关系如图所示(曲线上任何一点都表示平衡状态)。下列说法
正确的是 ( )
A.反应I2(aq)+I-(aq)===I3-(aq)的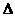 H>0
H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
13.恒温、恒压下,a molA和b molB在一个容积可变的容器中发生如下反应:
A(g)+2B(g)  2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是 ( )
2C(g),一段时间后达到平衡,生成n molC。则下列说法中正确的是 ( )
A.物质A、B的转化率之比为a∶b
B.当v正(A)=2v逆(B)时,可确定反应到达平衡状态
C.若起始时放入2a molA和2b molB,则达平衡时生成2n molC
D.起始时刻和达平衡后容器中的压强比为(a+b)∶(a+b-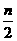 )
)
0.6mol·L-1和0.4mol·L-1,则达到平衡后,C的浓度小于0.8mol·L-1
D.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
12.t℃时,在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(I) 所示;若保持其他条件不变,温度分别为t1℃和t2℃时,C的体积分数(Φ)与时间的关系如图(Ⅱ)所示。则下列结论正确的是 ( )

A.达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动
B.达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.保持其他条件不变,若反应开始时A、B、C的浓度分别为0.2mol·L-1、
11.碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)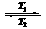 WI2(g) ΔH<0(温度T1<T2=。下列说法不正确的是 ( )
WI2(g) ΔH<0(温度T1<T2=。下列说法不正确的是 ( )
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越高
C.该反应的平衡常数表达式是K =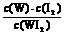
D.利用该反应原理可以提纯钨
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com