
题目列表(包括答案和解析)
2.美国科学家用有机分子和球形笼状分子C60,首次制成了“纳米车”(如图),每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。 “纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是( )
“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是( )
A.我们可以直接用肉眼清晰地看到这种“纳米车”的运动
B.“纳米车”的诞生,说明人类操纵分子的技术进入一个
新阶段
C.C60是一种新型化合物
D.C60熔点比金刚石熔点高
1.信息、材料、能源被称为新科技革命的“三大支柱”。下列有关资讯错误的是 ( )
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前,中、美、日等国掌握的陶瓷发动机技术,能较大程度地降低能耗,节约能源
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料,属
于原子晶体
5.(15分)某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
I.实验装置如下图所示(6分)

(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气。写出该反应的化学方程式_______________________________________________________________________
(2)当集气瓶中充满红棕色气体时,木条复燃了。有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?____________(填“正确”或“不正确”),理由是_______ _
_______________________________________________________________________
II.实验装置如右图所示:(6分)
(1)
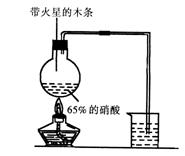 写出浓硝酸受热分解的化学方程式:
写出浓硝酸受热分解的化学方程式:
__________________________________。(2分)
(2)实验开始后木条上的火星逐渐熄灭,有的同学
提出“NO2不能支持木条的燃烧”的结论。你
认为这一结论是否正确?________(填“正确”
或“不正确”),理由是
__________________________________________
____________。(4分)
III.为了更能直接说明“NO2能否支持木条的燃烧”
这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。(3分)
4.(13分)纯碱中常含有少量NaCl杂质,某实验小组用下图装置测定n g纯碱样品中Na2CO3的质量分数。

(1)测定实验的步骤为______________________。(填序号)(3分)
①称量盛有碱石灰的干燥管D的质量为m1 g;
②称量n g纯碱样品,将其放入锥形瓶内;
③按装置图组装仪器,并检查气密性;
④再次称量干燥管D的总质量为m2 g;
⑤从分液漏斗注入一定量的稀硫酸,直到B中不再产生气体为止。再缓缓鼓入空气一段时间。
(2)在用托盘天平称量样品时,如果天平的指针向右偏转,说明______________________
__________________________________________________________。(2分)
(3)装置E的作用是__________________________________,步骤⑤中“缓缓鼓入空气一段时间”的原因是_______________________________________________。(4分)
(4)A中NaOH溶液的作用________________________________。 (2分)
(5)该试样中纯碱的质量分数的计算式为_________________________________。(2分)
1. (18分)工业生产的纯碱中常含有少量的食盐。某学生为测定纯碱中Na2CO3的质量百分含量,设计了如图实验装置。
(18分)工业生产的纯碱中常含有少量的食盐。某学生为测定纯碱中Na2CO3的质量百分含量,设计了如图实验装置。
操作步骤如下:
①检查装置的气密性;
②在干燥管D、E内填满颗粒状碱石灰,称量D的总持量(W1g);
③称取一定质量的纯碱(W2g),并所它放进广口瓶B里;
④打开分洲漏斗的活塞,将稀硫酸缓缓滴入B瓶中,至不再产生气体为止。
⑤打开弹簧夹a,缓缓鼓入空气约5分钟后,再称干燥管D的总质量(W3g);
(1)A瓶中盛的试剂是 ,作用是 。
(2)C瓶中盛的试剂是 ,作用是 。
(3)鼓入空气的目的是 。
(4)干燥管E的作用是 。
(5)如果去掉装置A,测定结果将(填偏大、偏小或无影响) ;如果去掉装置C,测定结果将 。
(6)计算Na2CO3的质量百分含量的算式为 。
 2.(12分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
2.(12分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15mL30%KOH溶液,并置于水浴中;③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
。
反应完毕生经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解曲线的是
 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)
(填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是 。
(4)实验中可观察到④的试管里的溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为 色 |
|
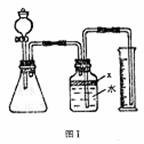 3.(15分)氮化铝(AIN)是一种新型的无机
3.(15分)氮化铝(AIN)是一种新型的无机
材料,广泛应用于集成电路生产领域。某氮
化铝样品中含有碳或氧化铝杂质,现用图I
装置进行实验,使氮化铝样品与NaOH溶液
反应(AIN+NaOH+H2O===NaAlO2+NH3↑),
根据反应所生成氨的体积来测定样品中氮化
铝的质量分数,并根据实验现象确定杂质的
成分。实验过程记录如下:
a.检查装置气密性;b.往锥形瓶中放入适量氮化铝样品,从分液漏斗往锥形瓶中加入过量浓NaOH溶液,立即发生剧烈反应,生成的氨将广口瓶中的水排入量筒中;c.实验结束后,测量量筒中收集到的水的体积(包括由广口瓶到量筒的导管内的水柱的体积),进行计算。
(1)本实验中,检查装置气密性的方法是
(2)广口瓶中的试剂x最好选用 。(填选项的标号)
A.汽油 B.酒精 C.植物油 D.四氯化碳
(3)广口瓶中的液体没有装满(上方留有少量空间),实验结果测得的NH3的体积将
(填“偏大”、“偏小”或“不受影响”)。
(4)实验结束后,若观察到受锥形瓶中还有固体,则样品中含有的杂质是 。(填杂质名称)
(5)若实验中测得样品的质量为wg,氨的体积为aL(已折算成标准状况),则样品中AlN的质量分数为 。(AlN的摩尔质量为41g·mol-1)
30.某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeC13·6H2O晶体。(图中夹持及屋气处理装置均已略去)
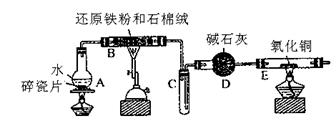
(1)装置B中发生反应的化学方程是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法: 。
(4)该小组学生利用上述滤液制取FeC13·6H2O晶体,设计流程如下:
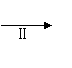

滤液 FeC13溶液 FeC13·6H2O晶体
①步骤Ⅱ中通入C12的作用是 。
②步骤Ⅱ从FeC13稀溶液中得到FeC13·6H2O晶体的主要操作包括: 。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明) 。
4.(16)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无气味的气体。这四种化合物具有如下图的转化关系(部分反应物、产物及反应条件已略去)。

请回答:
(1)W为 分子(填“极性”或“非极性”)。
(2)X与Y在溶液中反应的离子方程式是 。
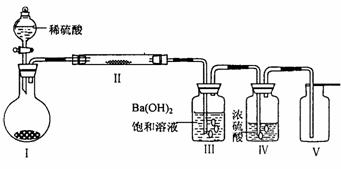 (3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。
①装置I反应的化学方程式是: 。
装置II中物质的电子式是: 。
②用X含有的四种元素中的两种组成的某化合物M,在催化剂存在的条件下制备并收集纯净干燥的装置V中的气体,该化合物M的结构式是 ,所需仪器装置是 (从上图中选择必要装置,填写编号)。
(4)向乙溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 。
3.(15分)用下列仪器、药品验证由铜和适量浓硝酸反应产生的NO2气体中含NO(N2)和O2的用量可自由控制)。已知:
①NO+NO2+2OH-=2NO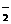 +H2O;2NO2+2OH-=NO
+H2O;2NO2+2OH-=NO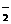 +NO
+NO +H2O;
+H2O;
②气体液化温度:NO2 21℃ ,NO -152℃
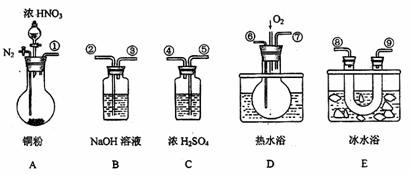
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为①接 、 、接 、 接 、 接 。
(2)反应前先通入N2目的是 。
(3)确认气体中含NO的现象是 。
(4)装置E的作用是 。
(5)如果D中通入O2过量,则B容器中反应后只生成一种溶质,则装置B中发生反应的化学方程式为: 。
2.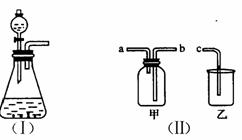 (15分)下图(I)是实验室制取气体的一种发生装置。
(15分)下图(I)是实验室制取气体的一种发生装置。
(1)若用上述装置制取O2,可选择二氧化锰和 反应,写出此反应的化学方程式 。
(2)选择图(II)中的甲装置,若用排空气法收集CO2,收集时气体应从 口进气;若用排水法收集O2,收集时气体应从 口进气。(填“a”或“b”)
(3)实验室以KMnO4和浓盐酸为反应物,利用(I)、(II)装置组合制取氯气,反应方程式如下:
□KMnO4+□HCl=□KCl+□MnCl2+□Cl2↑+□H2O
①配平上述反应方程式(在空格里填上适合的计量系数);
盐酸在此反应中体现的性质为
②组合装置乙中盛放氢氧化钠溶液,发生反应的离子方程式为 。
(4)广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种用途的装置。如充当集气瓶,还可作 (填写一种即可)
1.(16分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下。
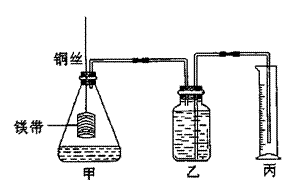
①配制浓度均为1mol/L盐酸和醋酸溶液。
②用 量取10.00mL 1 mol/L盐酸和醋酸溶液分别加入两个相同的锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 。
④将广口瓶中装足量的水,按图连接好装置;检查装置的气密性。
⑤将铜丝向下移动,使足量的镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 。
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读量筒中水的体积前,应
。读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述④检查该装置气密性的操作与观察方法:
。
(2)本实验中应选用 (填序号)的量筒。
A.100mL B.200mL C.500mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩擦体积的计算公式为:
Vm= 。
(4)简述速率不等的原因 ,
铜丝不与酸接触的原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com