
题目列表(包括答案和解析)
6.(2010·天河模拟)下列有关实验的说法错误的是( )
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比
色卡对照
B.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
[解析]选D。不能够直接将固体或者浓溶液在容量瓶中溶解或者稀释,D选项错误。
5.(2010·韶关模拟)下列有关实验操作的说法正确的是( )
A.SO2通入品红溶液和高锰酸钾溶液中,溶液均褪色,说明SO2具有漂白性
B.用蒸馏水将PH试纸先润湿,可用于检验氨气
C.在常温下,将氯化铝溶液蒸发结晶,最后能得到氯化铝晶体
D.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
[解析]选B。SO2使品红溶液褪色,显示漂白性,SO2使高锰酸钾溶液褪色,显示还原性,A选项错误;用蒸馏水将PH试纸润湿后,才可以检测氨气,氨气溶于水生成一水合氨,电离出氢氧根离子,使试纸变蓝,B选项正确;由于铝离子水解,蒸发会促进水解,蒸发后得到的是氢氧化铝,C选项错误;不能排除银离子的干扰,D选项错误。
4.(2010·肇庆模拟)下列对实验操作或对实验事实的描述正确的是( )
A. 用瓷坩埚熔化各种钠的化合物
B. 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
C. 配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏低
D. 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在稀盐酸中,然后用蒸馏水稀释并加入少量铁粉
[解析]选BD。不能用瓷坩埚熔化氢氧化钠、碳酸钠,因此A选项错误;氢氧化铝既溶于强酸也溶于强碱,但是氨水属于弱碱,因此Al2(SO4)3溶液和氨水互滴现象相同,B选项正确;定容俯视,导致加水少,浓度偏高,C选项错误;配制氯化亚铁溶液时,加稀盐酸防止Fe2+水解,加入铁粉防止Fe2+被氧化,D选项正确。
3.(2010·昆明模拟)除杂质时,为了保证杂质尽量被除去,加入的试剂必须稍过量,最后的过量物可以使用物理或化学方法除去。现要除去NaCl中少量的CaCl2、ZnCl2、Na2SO4杂质,下列选用试剂及其使用顺序正确的是 ( )
A.Na2CO3、BaCl2、HCl
B.BaCl2、Na2CO3、H2SO4
C.BaCl2、Na2CO3、HCl
D.Ba(NO3)2、Na2CO3、HCl
[解析]选C。根据除杂质的原则,本题加入试剂的顺序应是:Ba2+→CO32-→HCl,加稍过量BaCl2可除去Na2SO4,稍后加入的Na2CO3在除去CaCl2同时也除去了过量的BaCl2,最后再用盐酸除去过量的Na2CO3,过量的盐酸可依靠加热挥发而除去。
2.(2010·南开中学模拟)某校化学小组学生测定硫酸铜晶体里结晶水的含量。若实验测得硫酸铜晶体中结晶水的含量偏低,造成此结果可能的原因有( )
①加热前所用的坩埚未完全干燥 ②加热时有少量固体溅出
③样品中含有加热易挥发的杂质 ④在空气中冷却后称量
⑤加热至样品含有淡淡的蓝色时就冷却称量
A.②④ B.③⑤ C.①④ D.④⑤
[解析]选D。 w(结晶水的质量)= w1(加热前的质量)-w2(加热后的质量),根据公式可以轻松判断出①没有干燥会导致w1偏大,测得结晶水含量偏高;②少量固体溅出,导致w2偏小,测得结晶水含量偏高;③样品中含有加热易挥发的杂质,致w2偏小,测得结晶水含量偏高;④在空气中冷却后称量,导致加热后的坩埚吸水,w2偏大,测得结晶水含量偏低;⑤加热至样品含有淡淡的蓝色时,没有将水完全蒸发掉,导致w2偏大测得结晶水含量偏低,因此D选项正确。
1.(2010·南开中学模拟)下列物质分离过程中涉及共价键断裂的是( )
A.用渗析法除去淀粉胶体中的少量NaCl B.用饱和食盐水洗去Cl2中的少量HCl
C.用CCl4萃取碘水中的碘 D.用升华法除去NaCl中混有的少量碘
[解析]选B。A选项中破坏的是离子键;B选项中破坏的是共价键;C、D选项中无化学键破坏。
64.(09-10·福建福州八中高二下期中) (15分)、如图所示,甲、乙两池电极材料都是铁棒与碳棒,乙池中电子电子流动方向见图,回答下列问题:
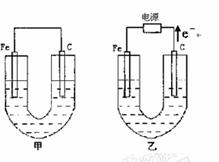
(1)若两池中均盛200mL饱和NaCl溶液和酚酞的混合液,反应开始后:
①甲池中 极,乙池中的
极附近溶液变红(填“正”或“负”或“阴”或“阳”)。
②甲池碳极上电极反应式是
乙池中Fe电极上反应式为 。
③若乙池中收集到1.12L(标况下)有色气体时,停止实验,忽略池中溶液体积的变化,则池中溶液的c(OH-)约为 ,要使溶液恢复到电解前的相同的状况,应向溶液中补充一定量的
A.盐酸 B. NaCl固体 C. NaCl溶液 D. HCl气体
(2)若两池中均盛有200mL 2mol•L-1CuSO4溶液:
①反应一段时间后,有红色物质析出的是甲池中的 棒,乙池中的 棒。
②写出乙池通电时总反应的离子方程式: 。
③若乙池中通过1.2mol 电子后停止实验,则乙池中共可收集到气
体的体积为 (标准状况下)。
答案:  ③0.5mol•L-1,D( 3分)
③0.5mol•L-1,D( 3分)
(2)①碳, 铁。( 2分)
②2Cu2+ + 2H2O O2↑+ Cu2++
4H+。(2分)
O2↑+ Cu2++
4H+。(2分)
③6.72L(2分)
0.(4)(2分)1 mol·L-1 (2分)CuO,
63.(09-10·浙江宁波四中高二下期中) 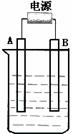 (10分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重 1.6 g。请回答下列问题
(10分)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重 1.6 g。请回答下列问题
(1)A接的是电源的 极。
(2)写出电解时B电极发生反应的电极反应式
。
(3)反应的总离子方程式
。
(4)电解后溶液中氢离子的浓度为 ;要使电解后溶液恢复到电解前的状态,则可加入 , [ 填NaOH或CuO或Cu(OH)2 ]
答案:10分)(1) (2分)负
(2) (2分)4OH--4e-=2H2O+O2↑
(3) (2分)2Cu2++2H2O 2Cu+O2↑+4H+
62.(09-10·浙江白云中学高二下期中) (10分)大家知道:Cu+H2SO4(稀)= Cu SO4+H2通常不能反应。请回答:
(1)试说明此反应在一般情况下不能发生反应的原因是____________________。
(2)若向稀H2SO4溶液中通入热的空气,则会发现铜会逐渐溶解。试写出有关反应的化学方程式________________________________________
(3)根据你所学过的知识,设法使其中的反应能发生,具体的方法是:______________________________________________________;
反应原理是:阳极___________________________________________
阴极___________________________________

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com