
题目列表(包括答案和解析)
5、示例电池和电极反应:
①干电池
电极反应:负极(锌筒):Zn - 2e- = Zn2+;
正极(石墨):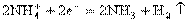
总反应:
②.铅蓄电池
电极反应: 负极: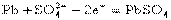
正极: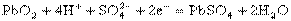
总反应:
③.燃料电池
电极反应: 负极:2H2 + 4OH- -2e- = 4H2O 正极:O2 + 2H2O + 2e- = 4OH-
电池的总反应为:2H2 + O2 = 2H2O
4、微粒移动方向:
电流由正到负。电子由负到正。 溶液中离子:阳向正阴向负。
3、电极反应和现象:
负极:一般为活泼金属,失电子,化合价升高,发生氧化反应。本身被溶解。
正极:一般为较不活泼金属(或非金属),本身不反应。溶液中的阳离子得电子,化合价降低,发生还原反应。电极上有单质生成(气体或金属)。
简略为:负氧正还 负溶正析
2、形成条件:1能发生氧化还原反应,2活性不同的两个电极,3闭合回路,4电解质溶液。
1、原电池:将_化学_能转化为__电_能的装置。
_直接_从自然界取得的能源称为一次能源,如流水、风力、原煤、石油、天然气等,一次能源经过加工,转换得到的能源为二次能源,如电力、蒸汽、氢能等。
10.煤中含有少量硫,如果煤中混合适量的氧化钙,则在煤的燃烧过程中,可以减少二氧化硫的排放,用化学元素方程式表示其原因。
第二节 化学能与电能
9. 能源可化分为一级能源和二级能源。自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:
2H2O(l)===2H2(g)+O2(g)该反应要吸收大量的热
根据上述内容回答下列问题
(1)下列叙述正确的是( )
A.电能是二级能源 B.水能是二级能源
C.天然气是一级能源 D.水煤气是一级能源
(2)关于用水制取二级能源氢气,以下研究方向下正确的是( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究水不分解的情况下,使氢气成为二级能源。
B. 设法将太阳光聚集,产生高温,使水分解产生氢气。
C. 寻找高效催化剂,使水分解产生氢气,同时释放能量。
D. 寻找特殊催化剂,用于开发廉价能量,以分解水制取氢气。
8.已知反应:X+Y == M+N为放热反应,对该反应的下列说法中正确的是( )
A.X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因为该反应为放热反应,故不必加热反应就可发生
7.下列反应既是氧化还原反应,又是放热反应的是( )
A.铝与稀盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.甲烷在氧气中的燃烧反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com