
题目列表(包括答案和解析)
6.(2009年淮安质检)将V1 mL 1.00 mol·-1L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50 mL)下列叙述正确的是( )

A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·-1L
D.该实验表明
有水生成的反应都是放热反应
5.(2010年汕头质检)下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)=CO2(g);ΔH1
C(s)+1/2O2(g)=CO(g);ΔH2
②S(s)+O2(g)=SO2(g);ΔH3
S(g)+O2(g)=SO2(g);ΔH4
③H2(g)+1/2O2(g)=H2O(l);ΔH5
2H2(g)+O2(g)=2H2O(l);ΔH6
④CaCO3(s)=CaO(s)+CO2(g);ΔH7
CaO(s)+H2O(l)=Ca(OH)2y(s);ΔH8
A.①
B.④
C.②③④
D.①②③
4.(2007年海南卷)已知:(1)Zn(s)+1/2O2(g)=ZnO(s);ΔH=-348.3 kJ/mol
(2)2Ag(s)+1/2O2(g)=Ag2O(s);ΔH=-31.0 kJ/mol则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的ΔH等于( )
A.-317.3 kJ/mol
B.-379.3 kJ/mol
C.-332.8 kJ/mol
D.+317.3 kJ/mol
3.从如右图所示的某气体反应的能量变化分析,以下判断错误的是( )

A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
2.已知在一定条件下,CO的燃烧热为283 kJ/mol,CH4的燃烧热为890 kJ/mol,由1 mol CO和
3 mol CH4组成混合气体在上述条件下充分燃烧,释放的热量为( )
A.2912 kJ
B.2953 kJ
C.3236 kJ
D.3867 kJ
1.下列各图中,表示正反应是吸热反应的是( )

12.(2009年浙江卷)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO催化剂2CO2+N2为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
|
时间/s |
0 |
1 |
2 |
|
c(NO)mol·-1L |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
|
c(CO)/mol·-1L |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
|
时间/s |
3 |
4 |
5 |
|
c(NO)/mol·-1L |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/mol·-1L |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的ΔH____________0(填写“>”、“<”、“=”)。
(2)前2 s内的平均反应速率v(N2)=____________。
(3)在该温度下,反应的平衡常数K=____________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是____________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:
在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验编号 |
T/℃ |
NO初始浓度mol·-1L |
CO初始浓度/ mol·-1L |
催化剂的比表面积/m2·g-1 |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
|
|
|
124 |
|
Ⅲ |
350 |
|
|
124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO
浓度随时间变化的趋势曲线图,并标明
11.(2008年宁夏卷)已知可逆反应:M(g)+N(g)=P(g)+Q(g),ΔH>0,请回答下列问题:(1)在某温度下,反应物的起始浓度分别为:c(M)=1 mol·-1L,
c(N)=2.4 mol·-1L;达到平衡后,M的转化率为60%,此时N的转化率为____________;
(2)若反应温度升高,M的转化率____________(填“增大”“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4 mol·-1L,c(N)=a mol·-1L;达到平衡后,c(P)=2 mol·-1L,a=____________;
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol·-1L,达到平衡后,M的转化率为____________。
10.(2009年南京质检)已知化学反应①:
Fe(s)+CO2(g)=FeO(s)+CO(g),其平衡常数为K1;化学反应②:
Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常数为K2。在温度
973 K和1173 K情况下,K1、K2的值分别如下:
|
温度 |
K1 |
K2 |
|
973 K |
1.47 |
2.38 |
|
1173 K |
2.15 |
1.67 |
(1)通常表格中的数值可以推断:反应①是____________(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请
你写出该反应的平衡常数K3的数学表达式:K3=____________。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式____________。据此关系式及上表数据,也能推断出反应③是____________(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有____________(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
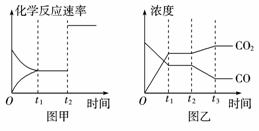
(4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是____________ 。
②图乙中t2时刻发生改变的条件是____________ 。
9.(2010年济南质检)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)=CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
|
T/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________。
(2)该反应为____________反应(选填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是__________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:
c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________ ℃。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com