
题目列表(包括答案和解析)
4.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.NaOH
B.H2SO4
C.AgNO3
D.Na2SO4
3.(2010年郑州质检)用如下图所示装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
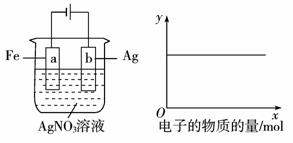 ①c(Ag+) ②c(NO3-)
①c(Ag+) ②c(NO3-)
③a棒的质量 ④b棒的质量
⑤溶液的pH
A.①③
B.③④
C.①②④
D.①②⑤
2.(2009年青岛月考)利用如右图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色。下列说法错误的是( )
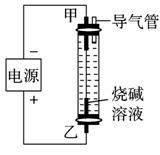
A.烧碱溶液注入容器前,需预先煮沸
B.甲电极上有氢气冒出
C.只能用铁作甲电极和乙电极
D.可用食盐水代替烧碱溶液
1.下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作为阳极
B.电解法精炼粗铜,用纯铜作为阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作为阴极
D.在镀件上电镀锌,用锌作为阳极
12.(2009年淮安质检)共价键都有键能之说,键能是指拆开1 mol共价键所需要吸收的能量。如H-H键的键能是436 kJ·mo-1L,是指使1 mol H2分子变成2 mol H原子需吸收436 kJ的能量。
(1)已知H-Cl键的键能为431.4 kJ·mo-1L,下列关于键能的叙述正确的是( )
A.每生成1 mol H-Cl键放出431.4 kJ能量
B.每生成1 mol H-Cl键吸收431.4 kJ能量
C.每拆开1 mol H-Cl键放出431.4 kJ能量
D.每拆开1 mol H-Cl键吸收431.4 kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是( )
|
化学键 |
H-H |
H-F |
H-Cl |
H-Br |
|
键能/kJ·mo-1L |
436 |
565 |
431 |
368 |
A.HF B.HCl
C.HBr D.H2
(3)能用键能大小解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243 kJ·mo-1L,试求1 mol H2在足量的Cl2中燃烧,理论上放出的热量是多少?(其他形式的能量很少,可忽略不计)
(5)已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1 mol H-H键断裂时吸收热量为多少?
11.某反应过程中的能量变化如下图所示:
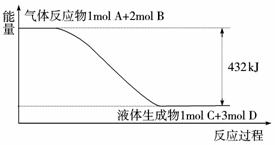
(1)写出该反应的热化学方程式:____________ ____________ 。
(2)在溶液中进行化学反应的物质,其状态标为“aq”,已知0.5 mol H2SO4在溶液中与足量氢氧化钠反应放出57.3 kJ的热量,用离子方程式写出该反应的热化学方程式:
____________ 。
(3)合成氨反应的热化学方程式:N2(g)+3H2(g)=2NH3(g);ΔH=-92.2 kJ/mol已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中要投放多少摩尔的N2?
10.“嫦娥一号”登月成功,实现了中国人“奔月”的梦想。(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是____________;____________(请写两条)。
(2)下列是298 K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式:H2(g)+1/2O2(g)=H2O(l);ΔH=-285.8 kJ·mo-1L
C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ·mo-1L
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);ΔH=-5518 kJ·mo-1L
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890.3 kJ·mo-1L
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是____________,通过计算说明等质量的氢气和碳燃烧时产生热量的比是____________(保留1位小数)。
9.根据下图所示,写出下列反应的热化学反应方程式,并回答相关问题:
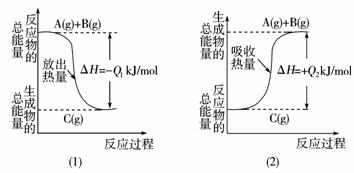
(1)____________ 。(2)____________ 。Q1与Q2的关系:
Q1____________Q2(填“大于”、“小于”或“等于”)。
8.下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量少
B.氢气的燃烧热为285.8 kJ·mo-1L,则氢气燃烧的热化学方程式为:
2H2(g)+O2(g)=2H2O(l);ΔH=-285.8 kJ·mo-1L
C.Ba(OH)2y·8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l);ΔH<0
D.已知中和热为57.3 kJ·mo-1L,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ
7.(2009年上海卷)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下
(Q1、Q2均为正值):H2(g)+Cl2(g)→2HCl(g);ΔH1=-Q1 kJ·mo-1L H2(g)+Br2(g)→2HBr(g);ΔH2=-Q2 kJ·mo-1L
有关上述反应的叙述正确的是( )
A.Q1>Q2
B.生成物总能量均高于反应物总能量
C.生成1 mol HCl气体时放出Q1热量
D.1 mol HBr(g)具有的能量大于1 mol HBr(l)具有的能量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com