
题目列表(包括答案和解析)
11.某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:
有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为-__________________________________________________________________________________________ 。
方案Ⅱ:
有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
正极反应式:____________ ;
负极反应式:____________ 。
方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):____________ ____________ ,
用离子方程式表示其反应原理:____________ 。
10.ZPower电池使用锌聚合物作为阳极、银纳米颗粒作为阴极,其安全性类似于传统的碱性电池,并且其材料95%可回收,该电池的容量比同体积的锂电池高30%。银锌电池广泛用作各种电子仪器的电源,它的充、放电过程可表示为2Ag+Zn(OH)2 Ag2O+Zn+H2O。
Ag2O+Zn+H2O。
根据上述信息回答下列问题:
(1)电池在放电时,作为负极的是____________,电极反应式为______________;正极电极反应式为____________ 。
(2)该电池属于____________性电池(填“酸”、“碱”或“中”)。
(3)写出充电时的反应式:
阳极:____________ ;
阴极:____________ 。
3.84 g,则该原电池的工作效率是____________(指参加原电池反应的锌占反应总量的百分率)。
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。为什么锌失去的电子不能持续通过导线流向铜极给Cu2+?____________。
(3)实验三中盐桥中的K+流向____________溶液(填ZnSO4或CuSO4),如果Zn的消耗速率为1×10-3 mol/s,则K+的迁移速率为____________ mol/s。与实验一比较,实验三原电池的工作效率大大提高,原因是____________ 。
(4)你根据实验一、二、三可得出的结论是____________ ____________(写出两点即可)。
9.某校化学兴趣小组为了探究原电池工作原理,进行如下系列实验,请分析实验结果后回答相应问题。
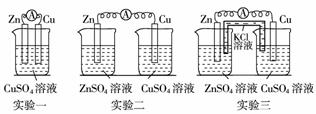
(1)实验一中铜片、锌片表面均有红色物质析出,电流
计指针偏转,但较短时间内电流即明显减小。实验结束时测得锌片减少了3.94 g,铜片增重了
8.(2009年淄博质检)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:

下列叙述不正确的是( )
A.放电时负极反应为:Zn+2OH-=Zn(OH)2+2e-
B.充电时阳极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
7.某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴甲基橙试液,按如右图所示的装置进行实验,过一段时间后观察。下列现象不可能出现的是( )
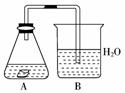
A.B中导气管中产生气泡
B.B中导气管里形成一段水柱
C.金属片剪口变红
D.锌被腐蚀
6.(2010年黄冈质检)将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,
即可产生电流,称为燃料电池,下列叙述正确的是( )
①通入CH4的电极为正极;
②正极的电极反应是O2+2H2O+4e-=4OH-;
③通入CH4的电极反应式是CH4+2O2+4e-=CO2+2H2O;
④负极的电极反应式是CH4+10OH-=CO32-+7H2O+8e-;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动。
A.①③⑤
B.②④⑥
C.④⑤⑥
D.①②③
5.(2009年江苏卷)以葡萄糖为燃料的微生物
燃料电池结构示意图如右图所示。关于该电池的叙述正确的是( )
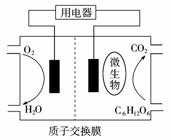
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O2-4e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4/6 L
4.X、Y、Z、M、N代表五种金属,有以下化学反应:①水溶液中:X+Y2+=X2++Y ②Z+2H2O(冷)=Z(OH)2+H2↑ ③M、N为电极与N
盐溶液组成原电池,发生的电极反应为:M→M2++2e- ④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化这五种金属的活动性由弱到强的顺序是( )
A.M<N<Y<X<Z__________________
B.N<M<X<Y<Z
C.N<M<Y<X<Z
D.X<Z<N<M<Y
3.在如右图所示的装置中,a为金属(在金属活动性顺序表中排在H前),b为碳棒,关于此装置的各种叙述不正确的是( )
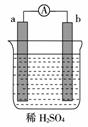
A.碳棒上有气体放出,
溶液pH变大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极到b极
D.a极上发生了氧化反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com