
题目列表(包括答案和解析)
9.近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是( )
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.以石油、天然气为原料
(2)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式为:
C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ·mo-1L
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 kJ·mo-1L
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是______________。
(3)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、
TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式____________ 。
8.(2009年云浮质检)灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g);ΔH1②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g);ΔH2③Sn(s,灰)[FY(KN]>13.2 ℃/<13.2 ℃Sn(s,白);ΔH3=+2.1 kJ·mo-1L下列说法正确的是( )
A.ΔH1<ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2 ℃的环境中,
会自行毁坏
7.分析下面的能量变化示意图,确定下列选项中正确的是( )
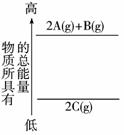
A.2A(g)+B(g)=2C(g);ΔH<0
B.2A(g)+B(g)=2C(g);ΔH>0
C.2A+B=2C;ΔH<0
D.2C(g)=2A(g)+B(g);ΔH>0
6.(2009年珠海模拟)在一定条件下发生化学反应:2SO2(g)+O2(g)=2SO23(g);ΔH=-197 kJ·mo-1L现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
|
容器 |
SO2(mol) |
O2(mol) |
N2(mol) |
Q(kJ) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
2 |
1 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述不正确的是( )
A.在上述条件下反应生成1 mol SO23气体放热98.5 kJ
B.上述条件下每摩尔该反应进行到底时放出的热量为197 kJ
C.Q1=2Q2=2Q3=197 kJ
D.2Q2=2Q3<Q1<197 kJ
5.(2009年四川卷)25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l);ΔH=-57.3 kJ/mol
B.KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l);ΔH=-57.3 kJ/mol
C.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g);ΔH=-5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l);ΔH=-5518 kJ/mol
4.半导体工业用石英砂做原料通过三个重要反应生产单质硅

生产1.00 kg纯硅的总反应热为( )
A.-21435.71 kJ
B.-600.20 kJ
C.+21435.71 kJ
D.+1965.10 kJ
3.强酸与强碱的稀溶液发生中和反应:H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3 kJ·mo-1L分别向1 L 0.5 mol·-1L的NaOH溶液中加入:①稀醋酸,②浓硫酸,③稀硝酸,恰好完全反应的热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( )
A.ΔH1>ΔH2>ΔH3
B.ΔH2<ΔH1<ΔH3
C.ΔH1=ΔH2=ΔH3
D.ΔH1>ΔH3>ΔH2
2.环境是人类生存和活动的场所。下列有关人类满足生活和生产活动需求做法的说法中,不正确的是( )
A.第29届奥运会的火炬燃料丙烷燃烧产物为二氧化碳和水,符合中国政府办一个“绿色奥运”的承诺
B.“长征”系列火箭为我国的航天事业立下了汗马功劳,其推进剂(偏二甲肼/四氧化二氮)属于环保燃料
C.2007年在太湖发生的蓝藻“水华”现象是该区域的生活污水、工业废水等造成水域富营养化的结果
D.研究人员用植物碳水化合物制造出了柴油燃料,属清洁的可再生能源
1.下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸铵受热分解
B.乙烷燃烧
C.铝粉与硫酸反应
D.氧化钠溶于水
12.(2009年枣庄质检)将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
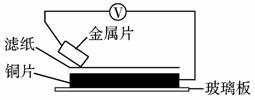
|
金属 |
电流方向 |
电压(V) |
|
A |
Cu→A/ |
+0.78 |
|
B |
B→Cu |
-0.15 |
|
C |
Cu→C |
+1.35 |
|
D |
Cu→D |
+0.30 |
已知:构成两电极的金属活动性相差越大,电压表的读数越大。请依据表中数据判断:
(1)____________金属可能是最强的还原剂。
(2)____________金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是____________(填字母)。金属对应的原电池的电极反应为:
负极:______________,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com