
题目列表(包括答案和解析)
1、(2010·郑州模拟)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- → 34CO2+10H2O。试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
(4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水
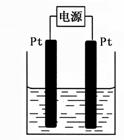
① 写出反应的离子方程式 。
② 将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③ 若电解后得到200mL 3.25mol/LNaOH溶液,则消耗C4H10 的体积在标准状况下为 mL。
[解析](1)燃料电池的化学反应方程式即有机物的燃烧方程式
(2)用总化学方程式减去负极电极反应式即得正极电极反应式
(3)因为负极消耗CO32-而生成CO2,所以要保持稳定,正极需要生成CO32-,所需CO2可以由负极反应
产物提供
(4)电解饱和食盐水即电解电解质和水,据此写出离子方程式;根据氧化还原反应中化合价升降总数相
等,可以配平Cl2和I2的反应;根据串联电路中各电极得失电子数相等,电解后得到NaOH
12.(2009年文昌质检)在一定体积的0.005 mol·-1L的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。
(1)写出所发生反应的离子方程式。
(2)若反应后溶液中由水电离产生的OH-浓度为a mol·-1L,而相同pH的Na2CO3溶液中由水电离出的OH-为b mol·-1L,则a与b的关系为:____________(填序号)。
A.a>b B.a=10-8b
C.b=10-8a D.a=b
(3)若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,求Ba(OH)2溶液与NaHSO4溶液的体积之比。
11.(2009年启东质检)在温度T ℃下,某Ba(OH)2y的稀溶液中c(H+)=10-a mol·-1L,c(OH-)=10-b mol·-1L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T ℃____________25 ℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW=____________。
(2)b=____________,原Ba(OH)2的稀溶液的物质的量浓度为____________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀正好达最大量,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为____________,以及其中Na2SO4的物质的量浓度为____________。
10.随着溶液酸碱性的变化,酚酞分子结构发生转化而显示不同颜色:无色酚酞结构A=红色酚酞结构B。在化学实验课上,细心的某同学发现:当无色的酚酞溶液滴入到氢氧化钠溶液中时,溶液立刻变成红色,但是随后红色溶液又逐渐变成无色。对此,许多同学纷纷发表看法,主要有三种推测:
①红色酚酞结构被空气中的氧气氧化;②溶液吸收了空气中的二氧化碳,pH减小,红色褪去;③红色酚酞结构自动转化为另外一种无色酚酞结构C。为此在老师的指导下,同学们做了如下实验。分别取4 mL不同浓度的NaOH溶液于试管中,滴加2滴酚酞溶液,实验现象与数据如下表:
|
编号 |
/静置方式 |
NaOH溶液浓度 |
滴入2 滴酚酞溶液 |
加热至沸腾 |
冷却 |
再加热至沸腾 |
冷却 |
滴入适量稀盐酸 |
|
① |
敞口 |
1% |
变红, 30 min 后褪色 |
变红 |
褪色 |
变红 |
褪色/ |
变红 |
|
② |
密闭 |
1% |
变红, 29 min 后褪色 |
变红 |
褪色 |
变红 |
褪色/ |
变红 |
|
③ |
敞口 |
5% |
变红, 29 min 后褪色 |
变红 |
褪色 |
变红 |
褪色/ |
变红 |
|
④ |
密闭 |
5% |
变红, 29 min 后褪色 |
变红 |
褪色 |
变红 |
褪色/ |
变红 |
|
⑤ |
敞口 |
10% |
变红, 29 min 后褪色 |
变红 |
褪色 |
变红 |
褪色/ |
变红 |
|
⑥ |
密闭 |
10% |
变红, 29 min 后褪色 |
变红 |
褪色 |
变红 |
褪色/ |
变红 |
请回答下列问题:
(1)通过分析表中数据及现象,该组同学认为第①种推测不合理。理由是:_________ 。
(2)第②种推测也不合理。理由是____________ 。
(3)红色酚酞结构B转化为无色酚酞结构C是否为可逆反应:____________(填“是”或“否”),在各个滴入适量稀盐酸又变红的试管中加入足量稀盐酸产生的现象是____________ ____________
(4)红色酚酞结构B的热稳定性比无色酚酞结构C的热稳定性要____________(填“强”或“弱”),红色酚酞结构B转化为无色酚酞结构C是一个____________(填“吸”或“放”)热的过程。
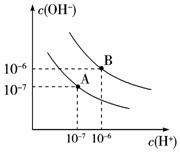
9.已知水在25 ℃和95 ℃时,其电离平衡曲线如右图所示:(1)则25 ℃时水的电离平衡曲线应为____________(填“A”或“B”),请说明理由____________
____________ 。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,
则NaOH溶液与H2SO4溶液的体积比为______________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________ 。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,
混合溶液的pH=5。请分析其原因:____________ 。
8.(2010年德州模拟)今有室温下四种溶液,有关叙述不正确的是( )
|
|
① |
② |
③ |
④ |
|
pH |
11 |
11 |
3 |
3 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>③>④
C.等体积③、④两溶液与足量的Zn反应,产生气体量③>④
D.温度下降10 ℃,①②③④四种溶液的pH均不变
7.(2010年枣庄检测)MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是 ( )

A.在x点时,ROH完全电离
B.在x点时[M+]=[R+]
C.MOH是一种强碱
D.稀释前,[ROH]=10[MOH]
6.(2009年济南模拟)取pH均为2的盐酸和醋酸各100 mL,分别加水稀释两倍后,再分别加入6.5 g锌粉,相同条件下充分反应,下列说法中,不正确的是( )
A.加水稀释后两溶液的pH不再相等
B.起始时醋酸与锌反应的速率大
C.醋酸与锌反应放出的氢气多
D.两者放出的氢气一样多
5.25 ℃时,pH=3的盐酸a L分别与下列三种溶液充分混合后,溶液均呈中性:①c(NH3·H2O)=10-3 mol·-1L的氨水b L,②c(OH-)=10-3 mol·-1L的氨水c L,③c(OH-)=10-3 mol·-1L的Ba(OH)2溶液d L。试判断a、b、c、d的数量大小关系为( )
A.a=b>c>d
B.b>a=d>c
C.b>a>d>c
D.c>a=d>b
4.常温下,0.1 mol·-1L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-10,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol·-1L
B.溶液中c(H+)+c(A-)=0.1 mol·-1L
C.与0.05 mol·-1L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
D.上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com