
题目列表(包括答案和解析)
2、(2010·济南模拟)在怛容条件下化学反应: 2SO2
( g ) + O2 ( g )  2SO3( g ) ; △ H
=-QkJ·mol-1
2SO3( g ) ; △ H
=-QkJ·mol-1
在上述条件下分别充入的气体和反应放出的热量 ( Q )如下表所列:
|
容器 |
SO2
(mol) |
O2(mol) |
N2(mol) |
Q(kJ·mol-1) |
|
甲 |
2 |
1 |
0 |
Q1 |
|
乙 |
1 |
0.5 |
0 |
Q2 |
|
丙 |
1 |
0.5 |
1 |
Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成 lmolSO3固体放热 Q/2 kJ B.2Q1 <2Q2=Q1<Q
C.Ql =2 Q2= 2Q3 = Q D.2Q2 = 2Q3 < Q1 < Q
[解析]选D。2SO2 ( g ) + O2 ( g )  2SO3( g ) ; △ H
=-QkJ·mol-1表示2 mol SO2 ( g ) 和 1 mol
2SO3( g ) ; △ H
=-QkJ·mol-1表示2 mol SO2 ( g ) 和 1 mol
O2 ( g )完全反应生成2 mol SO3( g )时放出QkJ的热量。由于SO3( g )变成SO3( s)要放出热量,所以在上述条件下反应生成 lmolSO3固体放热大于 Q/2 kJ;甲容器中物质不可能完全反应,所以Q1<Q;乙容器中物质不可能完全反应,且相对于甲容器,平衡逆向移动,所以Q2< Q1;丙容器中物质不可能完全反应且与乙容器中物质的转化率相同,所以Q2 = Q3。故有2Q2 = 2Q3 < Q1 < Q。
1、(2010·河南郑州模拟)已知:H2(g)+F2(g)= 2HF(g);△H=-270kJ/mol,下列说法正确的是( )
A.2LHF气体分解成1L的H2和1L的F2吸收270kJ热量
B.1molH2与1molF2反应生成2mol液态HF放出的热量小于270kJ
C.在相同条件下,1molH2与1molF2的能量总和大于2molHF气体的能量
D.1个H2分子与1个F2分子反应生成2个HF分子放出270kJ
[解析]选C。A项,应该是2molHF气体分解吸收270kJ热量;B项,生成液态HF时,放出的热量大于270kJ;D项同A。
18、(2010·合肥模拟)
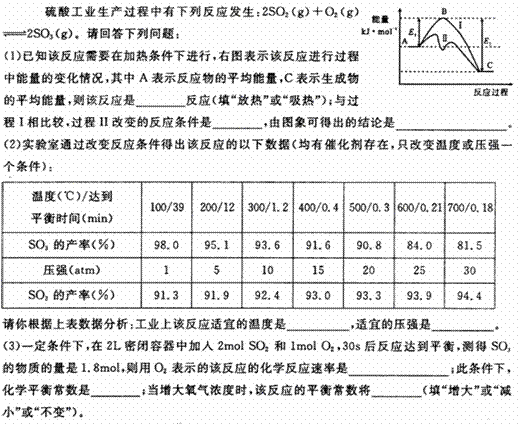
[答案](1)放热 加入了催化剂 催化剂可以降低活化能,但不能改变化学反应的反应热
(2)400-500°C 常压
(3)0.015mol·L-1 ·S-1或0.9mol·L-1 ·min-1 1620 不变
|

|
17、(2010·天津和平区模拟)氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
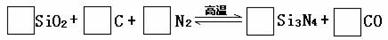
⑴配平上述反应的化学方程式(将化学计量数填在方框内)
⑵该反应中的氧化剂是 ,其还原产物是 ;
⑶该反应的平衡常数表达式为K= ;
⑷若知上述反应为放热反应,则其反应热为ΔH 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”)
⑸若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
⑹若已知CO生成速率为v(CO)=18mol/(L•min)则N2的消耗速率为v(N2)= mol/(L•min)。
[解析]本题是一道主要考查化学反应速率和化学平衡的综合题。
(1)用化合价升降法配平3SiO2+6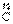 +2
+2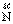 2
2 Si3N4+6CO
Si3N4+6CO
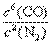 (2)N2为氧化剂,C为还原剂,Si3N4为还原产物。
(2)N2为氧化剂,C为还原剂,Si3N4为还原产物。
(3)因为N2、CO为气体,K= ;
(4)反应热用ΔH来表示,ΔH<0,升高温度,平衡向吸热方向移动,即向逆反应方向移动,K减小。
(5)增大压强, 平衡向气体体积减小的方向移动,即向逆反应方向移动。
(6)速率之比等于化学计量数之比,则N2消耗速率为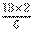 mol·(L·min)-1=6 mol·(L·min)-1。
mol·(L·min)-1=6 mol·(L·min)-1。
[答案](1)3 6 2 1 6 (2)N2 (3)Si3N4 (4)小于 减小 (5)逆 (6) 6
16、(2010·海南琼海模拟)在一体积为1L的密闭容器中发生反应:2HI(g)
 H2(g) + I2(g) ,当HI气体的起始浓度为1mol/L,H2和I2气体的起始浓度为0时,出现如下可能的图像
H2(g) + I2(g) ,当HI气体的起始浓度为1mol/L,H2和I2气体的起始浓度为0时,出现如下可能的图像
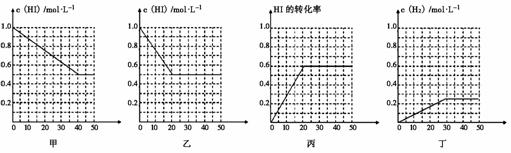
下列有关说法正确的是( )
A、甲、乙中的反应温度不同,压强相同
B、甲中可能未使用催化剂,乙中可能使用了催化剂
C、丙中的平衡混合物中,物质H2的浓度等于0.6mol/L
D、丁和乙比较,丁中可能增大了反应体系的压强
[答案]选B。
15、(2010·北京首都学院附中模拟)在一定条件下,反应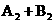
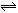 2AB;△H = Q kJ/mol 的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a为500℃,b为300℃时的情况(其他条件不变),c则为在时刻
2AB;△H = Q kJ/mol 的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a为500℃,b为300℃时的情况(其他条件不变),c则为在时刻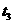 开始缩小容器容积(温度维持300℃)的情况,则( )
开始缩小容器容积(温度维持300℃)的情况,则( )
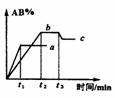
A.AB可能为气体 B.A2与B2都为气体 C.Q >0 D. Q <0
[答案]选D。
14、(2010·佛山模拟)2SO2(g)+O2(g) 2SO3(g) △H<0 是制备硫酸的重要反应。下列叙述正确的
2SO3(g) △H<0 是制备硫酸的重要反应。下列叙述正确的
是( )
A.选用有效的催化剂能增大正反应速率并提高SO2的转化率
B.增大反应体系的压强,反应速率不一定增大。
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,则SO3(g)生成的平均速率为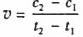
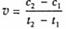 [解析]选D。A项,选用有效的催化剂能增大正反应速率,但是不能改变SO2的转化率;B项,增大反应体系的压强,反应物浓度不一定增大,所以反应速率不一定增大;C项,该反应是放热反应,降低温度会使平衡正向移动,但是反应速率降低,反应达到平衡的时间将变长;D项,在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,则SO3(g)生成的平均速率为
。
[解析]选D。A项,选用有效的催化剂能增大正反应速率,但是不能改变SO2的转化率;B项,增大反应体系的压强,反应物浓度不一定增大,所以反应速率不一定增大;C项,该反应是放热反应,降低温度会使平衡正向移动,但是反应速率降低,反应达到平衡的时间将变长;D项,在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,则SO3(g)生成的平均速率为
。
13、(2010·六安模拟)对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的百分含量一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大
④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了适宜的催化剂
A.②⑤ B.①② C.③⑤ D.④⑥
[解析]选A。减少生成物的量使化学平衡向正反应方向移动时,正反应速率一定大于逆反应速率,生成物的百分含量减小,生成物的产量增加,反应物的转化率增大,反应物的浓度一定降低;当增大反应物浓度使化学平衡向正反应方向移动时,正反应速率一定大于逆反应速率,生成物的产量增加,反应物的转化率降低,反应物的浓度增大。
12、(2010·广州模拟)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
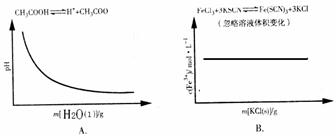
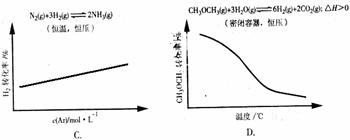
[解析]选B。A项,相当于将醋酸稀释,醋酸的电离程度增大,但是电离出的C(H+)减小,溶液的pH增大;B项,增加KCl的量对平衡无影响;C项,恒温、恒压下充入惰性气体,相当于减小物质浓度,结合化学方程式可知,浓度积大于平衡常数,所以平衡逆向移动,H2的转化率减小;D项,密闭容器中,恒压条件下升高温度,平衡向吸热方向移动,即向正反应方向移动,CH3O CH3的转化率增大。
0.3 mol·L-1,则vb=0.075 mol·L-1·s-1,故B项正确;平衡后,增大压强平衡正移,A的转化率增大,故C项错误;平衡后,升温平衡逆移,C的浓度减小,故D项错误。
11(2010·潍坊模拟)关于下列各图的叙述正确的是( )
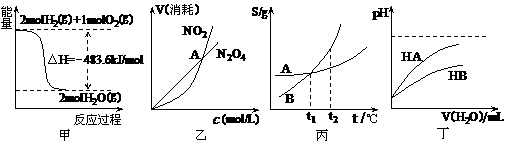

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
[答案]选D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com