
题目列表(包括答案和解析)
7.(2010·兰州模拟)X、Y-、Z+三种微粒的电子层结构相同,则一定不能再相等的是( )。
A.中子数 B.质量数 C.电子数 D.核电荷数
[解析]选D。电子层结构相同微粒核外电子数相同,因为三种微粒分别为原子、阴离子和阳离子,说明它们的质子数和核外电子数(核电荷数)不同,所以质子数一定不能再相等。
6.(2010·盐城模拟)某高校化学工作者创建了“元素立体周期律”,在原来二维周期表横列(X轴)和纵列(Y轴)基础上,增加了一个竖列(Z轴)。Z轴按“中质差”(中子数和质子数之差△Z=N-P)自上而下,递增顺序排列。原“二维元素表”中的相对原子质量由同位素“中质和”(中子数和质子数之和A=N+P)替代。下列说法正确的是( )。
A.“中质和”相同的核素一定是同一元素
B.“中质差”相同的核素一定是同一元素
C.N2-P2=A×△Z
D.至2008年,人们发现108种元素有m种核素,说明中质差一定有m种
[解析]选C。同一元素具有相同的质子数,“中质和”及“中质差”相同不能说明质子数一定相同,所以A和B选项错误;一种原子即为一种核素,它们的“中质差”可能相同,如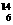 C和
C和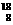 O的“中质差”都是2,所以D选项错误。
O的“中质差”都是2,所以D选项错误。
5.(2010·广州模拟)X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化合物的化学式可能是( )。
A.XYZ B.X3YZ C.XYZ2 D.X2YZ3
[解析]选D。X、Y、Z原子的最外层电子数分别为1、4、6,所以在它们形成的化合物中其化合价依次为+1、+4和-2,那么再根据化合价代数和为零,代入验证即得D选项的化合物符合条件。
4.(2010·兰州模拟)下列各组粒子中质子数和电子数均相同的是( )。
A.CH4、H2O、Na+ B.F2、Ar、HCl
C.H3O+、NH4+、Na D.O2-、Mg2+、Ne
[解析]选B。A选项中的三种微粒,电子数均10,质子数分别为10,10,11;C选项中的三种微粒,质子数均11,电子数分别为10,10,11;D选项中的三种微粒,电子数均10,质子数分别为8,12,10。
3.(2010·南通模拟)A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成的化学式可能表示为( )。
A.B3A2 B.BA2 C.A3B2 D.AB2
[解析]选B。分析过程如下表:
|
|
K |
L |
M |
元素 |
化学式 |
|
A |
b=2 |
a=6 |
|
O |
SiO2 |
|
B |
2 |
a+b=8 |
a-b=4 |
Si |
2.(2010·西南师大附中模拟)由H79Br和H81Br组成的混合气体对N2的相对密度为2.9,则混合气体中79Br和81Br的原子个数比为( )。
A.1∶1 B.1∶2 C.2∶3 D.3∶2
[解析]选C。混合气体的平均摩尔质量为: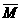 =2.9×28g/mol=81.2g/mol,设H79Br的原子百分数为x,则H81Br的原子百分数为(1-x),由元素相对原子质量概念有:81.2=80x+82(1-x),解得x=0.4,所以n(H79Br)∶n(H81Br)=0.4∶(1-0.4)=2∶3。
=2.9×28g/mol=81.2g/mol,设H79Br的原子百分数为x,则H81Br的原子百分数为(1-x),由元素相对原子质量概念有:81.2=80x+82(1-x),解得x=0.4,所以n(H79Br)∶n(H81Br)=0.4∶(1-0.4)=2∶3。
1.(2010·肇庆模拟)与铂同族的贵金属钯(Pd)有多种同位素。下列关于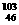 Pd、
Pd、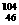 Pd的说法正确的是( )。
Pd的说法正确的是( )。
A.质子数相同,互称为同位素 B.中子数相同,化学性质不同
C.核外电子数相同,是同一种核素 D.质量数不同,互称为同素异形体
[解析]选A。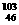 Pd和
Pd和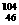 Pd是质子数相同,中子数不同的同种元素形成的不同核素,互为同位素。
Pd是质子数相同,中子数不同的同种元素形成的不同核素,互为同位素。
13、(2010·河北石家庄模拟) 下列五个化学方程式(X、Y、Z均为正值):
①C2H2(g)+H2(g)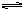 C2H4(g)
C2H4(g)
②CH4(g)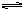 H2(g)+
H2(g)+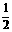 C2H4(g)
C2H4(g)
③C(s)+2H2(g)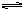 CH4(g); △H= -X kJ·mol-1
CH4(g); △H= -X kJ·mol-1
④C(s)+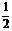 H2(g)
H2(g)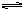
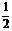 C2H2(g); △H= -Y kJ·mol-1
C2H2(g); △H= -Y kJ·mol-1
⑤C(s)+H2(g)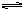
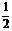 C2H4(g); △H= -ZkJ·mol-1
C2H4(g); △H= -ZkJ·mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③-⑤式中关于X、Y、Z的大小顺序排列正确的是:( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
[答案]B
|

|
12、(2010·台州模拟)已知:①2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ·mol-1
②H+(aq) + OH-(aq) = H2O(l) △H = -57.3kJ·mol-1。
下列说法中错误的是( )
A.①式表示25℃,101 kPa时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ
B.2H2(g) + O2(g) = 2H2O(g)中△H大于-571.6 kJ·mol-1
C.将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量为57.3 kJ
D.将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ
[答案]C。
11、(2010·苏州模拟)1840年,俄国化学家盖斯(G.H.Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ・mol-1,则1 mol C与O2反应生成CO的反应热ΔH为 ( )
A.-Y kJ・mol-1 B.-(10X-Y)kJ・mol-1
C.-(5X-0.5Y) kJ・mol-1 D.+(10X-Y) kJ・mol-1
[解析]选C。由3.6 g C与6.4 g O2完全反应,可知生成CO2与CO之比为1∶2。设3.6 g C按此方式反应,则生成1 mol CO2和2 mol CO,C单质燃烧热为Y kJ・mol-1,1 mol C与O2生成CO的反应热为:
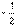 (10X-Y)kJ・mol-1,即-(5X-0.5Y)kJ・mol-1,C正确。
(10X-Y)kJ・mol-1,即-(5X-0.5Y)kJ・mol-1,C正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com