
题目列表(包括答案和解析)
17.(2010·宝鸡模拟)氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的
是( )。
A.35Cl原子所含质子数为18
B.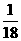 mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5g的35Cl2气体的体积为1.12L
D.35Cl2气体的摩尔质量为70
[解析]选B。质子数=原子序数=17,A选项错误;1个1H35Cl分子含中子数为(0+35-17)=18个,所以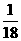 mol的该分子所含的中子数=
mol的该分子所含的中子数=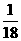 mol×18×NA≈6.02×1023,B选项正确;气体摩尔体积必须在标况下为22.4L/mol,C选项错误;35Cl2摩尔质量为70g/mol,D选项错误。
mol×18×NA≈6.02×1023,B选项正确;气体摩尔体积必须在标况下为22.4L/mol,C选项错误;35Cl2摩尔质量为70g/mol,D选项错误。
16.(2010·余杭模拟)正确掌握好化学用语是学好化学的基础,下列有关表述正确的
是( )。
①CO2的比例模型:
②O原子的结构示意图:
③聚乙烯的结构简式
④次氯酸的结构式:H-Cl-O
⑤NH3的电子式: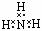
⑥明矾的化学式KAlSO412H2O
⑦作为相对原子质量测定标准的碳核素: C
C
⑧碳酸氢根离子的电离方程式:HCO3-+H2O H3O++CO32-
H3O++CO32-
⑨铝热反应:2Al+3MgO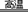 Al2O3+3Mg
Al2O3+3Mg
⑩Fe3O4溶于氢碘酸的离子方程式:Fe3O4+8H+ 2Fe3++Fe2++4H2O
2Fe3++Fe2++4H2O
A.⑧ B.除⑥⑦外 C.除③⑥⑦⑨外 D.①④⑧⑨⑩
[解析]选A。碳原子的半径比氧原子的大,所以CO2的比例模型中应该是中间的球比两边的球大,①错误;O原子的结构示意图为 ,图中给的是其电子层结构示意图,②错误;聚乙烯是高分子化合物,其结构简式中漏掉了右下角的n,③错误;O可以形成2个共价键,而H和Cl只能形成1个共价键,所以次氯酸的结构式应为:
,图中给的是其电子层结构示意图,②错误;聚乙烯是高分子化合物,其结构简式中漏掉了右下角的n,③错误;O可以形成2个共价键,而H和Cl只能形成1个共价键,所以次氯酸的结构式应为:
H-O-Cl,④错误;NH3的电子式中漏掉了N原子的孤对电子,正确的电子式为: ,⑤错误;明矾的化学式是:KAl(SO4)2·12H2O,⑥错误;
,⑤错误;明矾的化学式是:KAl(SO4)2·12H2O,⑥错误; C作为相对原子质量测定标准,⑦错误;HCO3-电离显酸性,有H+或H3O+生成,水解显碱性,有
C作为相对原子质量测定标准,⑦错误;HCO3-电离显酸性,有H+或H3O+生成,水解显碱性,有
OH-生成,⑧正确;铝热反应是金属铝和比它不活泼的金属氧化物之间发生的置换反应,Mg比Al活泼,该反应不能发生,⑨错误;Fe3+具有氧化性,能够将氢碘酸中的
I-氧化成I2,⑩错误,其正确的离子方程式为:Fe3O4+8H++2I- 3Fe2++I2+4H2O。
3Fe2++I2+4H2O。
15.(2010·铜陵模拟)某元素最高价含氧酸的化学式为HxROy,则气态氢化物的化学式( )。
A.H8+x-2yR B.H8(2x+y)R C.H2x+8+yR D.RH8+x-2y
[解析]选AD。根据中性微粒化合价之和为0,元素的最高正价与最低负价的绝对值之和等于8求,由化学式HxROy可知,R的最高化合价为+(2y-x)价,则其最低负价为-[8-(2y-x)]=-(8+ x-2y)价。若R为VIA~VIIA族元素,则其气态氢化物的化学式为H8+x-2yR,若R为IVA~VA族元素,则其气态氢化物的化学式为
RH8+x-2y。
14.(2010·银川模拟)据已有知识和元素性质递变规律来判断下列比较正确的是( )。
A.第二周期氢化物易燃性:CH4<NH3<H2O
B.第三周期氢化物稳定性:SiH4>PH3>H2S>HCl
C.化合物毒性:若PH3>NH3,则H2S>H2O
D.氢化物的还原性:HF>H2O>NH3>CH4
[解析]选C。采用同一主族和同一周期元素的性质的“递变性”来归纳推导。甲烷容易燃烧,而水不容易燃烧,可以推知“同一周期元素从左向右,氢化物的易燃性越来越弱”,A选项错误;根据同一周期元素从左向右,非金属性逐渐增强,氢化物的稳定性逐渐增强,氢化物的还原性逐渐减弱,B、D选项错误;若毒性PH3>NH3,说明“同一主族元素从上向下,氢化物的毒性越来越强”,C选项正确。
13.(2010·青州模拟)有三种短周期元素,最外层电子数之和为17,质子数之和为31。如果这三种元素中有一种是氩元素,则关于另外两种元素的说法不正确的是( )。
A.如果一种元素是金属元素,则另一种元素一定是稀有元素
B.如果一种元素的单质通常情况下是气体,则另一种元素的单质通常情况下是固体
C.如果一种元素的气态氢化物是三角锥形分子,则另一种元素的气态氢化物一定是正四面体形分子
D.如果一种元素的最高正价是+3,则另一种元素的单质有两种常见的同素异形体
[解析]选AC。由题所给信息可知,除氩以外的另两种短周期元素最外层电子数之和为9,质子数之和为13,可知内层电子数和为4,均为第二周期,可能为Li、Ne;Be、F;B、O;C、N组合。若一种是金属元素,另一种可能是Ne,也可能是氟,A不正确;B中一种是气体,另一种可能是Li、Be、B、C通常状况下是固体;C中气态氢化物是三角锥分子,是NH3,另一种元素的气态氢化物可以是CH4或其它气态烃,C不正确;D中最高价为正三价,是B元素,另一种元素是O元素,存在O2和O3两种常见同素异形体。
12.(2010·上海黄浦区模拟)X、Y、Z是原子序数依次递增的三种短周期元素。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物。则下列说法一定正确的是( )。
A.其中有硫元素 B.其中有金属元素
C.这三种元素能够组成盐 D.这三种元素均位于不同周期
[解析]选C。根据X原子的电子层数与它的核外电子总数相同可推断X为氢元素。根据Z原子的最外层电子数是次外层电子数的三倍可推断Z为氧元素。根据X、Y、Z原子序数依次递增、Y和Z可以形成两种以上气态化合物,可推断Y、Z同在第二周期,D选项错误;Z应为氮元素,三种元素能够组成硝酸铵(铵盐是唯一的全部由非金属元素组成的盐),C选项正确。
11.(2010·洛阳模拟)在短周期主族元素中,原子的核电荷数、核外电子层数、每层所容纳的电子数、主族序数均为偶数的有( )。
A.2种 B.3种 C.4种 D.8种
[解析]选D。在短周期主族元素中,核外电子层数为偶数的是第二周期,IIA、IVA、VIA三个主族序数为偶数,其原子的核电荷数、每层所容纳的电子数都是偶数。
10.(2010·通辽模拟)X、Y为短周期元素,X原子各电子层的电子数比为1∶4∶1,它比Y原子多3个电子。下列叙述正确的是( )。
A.X离子半径大于Y离子半径
B.X单质在空气中燃烧可生成两种化合物
C.X、Y形成的化合物与浓硫酸共热可在烧瓶中进行
D.电解X、Y形成的化合物的水溶液可得Y的单质。
[解析]选B。元素周期律(表)是中学化学的重要理论知识,对化学的学习和发展都有着不可替代的指导作用。所以也成为考查的重点。重点考查的是根据元素在周期表中的位置判定元素种类和元素间的反应及其产物的特点,同周期、同主族元素金属性和非金属性的递变规律,金属性和非金属性强弱的判断依据等。由X原子各电子层的电子数比为1∶4∶1可知X原子核外有3个电子层,由电子排布规律可知,K层最多不超过2个电子且排满后才能排L层,所以得到X为Mg,从而可知Y是F元素。A比较的是离子半径,对电子层结构相同的粒子核电荷数越大,粒子半径就越小,A不正确;Mg在空气中燃烧时既与O2反应生成MgO,也与N2反应生成Mg3N2,B正确;MgF2与浓H2SO4共热时会生成HF,对玻璃会有强烈的腐蚀作用,所以不能在烧瓶中进行实验,C项不正确;在水溶液中不可能得到F2,因为F2与水剧烈反应生成HF和O2,D也不正确。
9.(2010·北京西城区模拟)A、B为短周期元素,二者可以组合成多种中学生所熟知的化合物。在这些化合物中,A与B的原子个数比为A∶B=1∶2。已知A的原子序数为n,B的原子序数是 ①n+2 ②n+3 ③n+4 ④n+5 ⑤n+8 ⑥n-5 ⑦n-7 ⑧n-8中的几种,其中不符合题目要求的是( )。
A.①④ B.②⑧ C.③⑤ D.⑥⑦
[解析]选C。原子间能够形成原子个数为1∶2的化合物主要有下列情况:(1)第IA族与第VIA族元素;(2)第IIA族与第VIIA族元素;(3)第IVA族与第VIA族元素;(4)NO2;(5)SO2等,所以对应的原子序数关系不可能为m=n+4和m=n+8。
8.(2010·重庆模拟)2009年1月18日电,由552名中国科学院院士和中国工程院院士投票评选出的2008年世界十大科技进展新闻揭晓,“铁基超导材料研究获重大进展”名列榜单。由日本和中国科学家相继发现的新的高温超导材料--铁基超导材料:其成分是氟掺杂镧(La)氧铁砷(As)化合物。下列有关该材料的判断正确的是( )。
A.在周期表中,该材料所含五种元素有两种位于主族,三种位于副族
B.该超导材料所含五种元素有两种金属元素,三种非金属元素
C.该超导体材料耐酸腐蚀
D.在周期表中,铁位于第VIII族,砷位于第四周期
[解析]选D。依题意,该超导体含有氟、氧、砷、铁、镧五种元素,氟、氧、砷三种元素为主族元素,铁、镧为副族元素,A项错误;这五种元素中只有氟、氧两种非金属元素,B项错误;该超导体中含有铁,遇酸发生置换反应,C项错误;铁位于第四周期第VIII族,砷位于第四周期VA族,D项正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com