
题目列表(包括答案和解析)
8.(2010·北京东城区模拟)分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是( )。
A.根据纯净物的元素组成,将纯净物分为单质和化合物
B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类反应
[解析]选A。强、弱电解质的本质区别在于是否完全电离,而与导电性无关,如BaSO4难溶于水,其水溶液中自由移动的离子浓度很小,导电性极弱,但是溶于水的部分全部电离,属于强电解质,B选项错误;胶体、溶液和浊液三种分散系的本质区别在于分散质的直径不同,C选项错误;根据反应中的能量变化,将化学反应分为放热反应和吸热反应,D选项错误。
7.(2010·深圳模拟)分类是化学学习和研究的常用手段。下列分类依据和结论都正确的
是( )。
A.HClO、HNO3、浓H2SO4都具强氧化性,都是氧化性酸
B.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸
[解析]选A。只含有两种元素,其中一种是氧元素的化合物属于氧化物,所以HCOOH、
Cu2(OH)2CO3不属于氧化物,B选项错误;CH3CH2OH属于非电解质,C选项错误;HCOOH的电离方程式为:HCOOH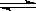 HCOO-+H+,只能电离出1个H+,属于一元酸,D选项错误。
HCOO-+H+,只能电离出1个H+,属于一元酸,D选项错误。
6.(2010·济南模拟)分类是学习和研究化学的一种常用的科学方法。下列分类合理
的( )。
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
④根据反应的热效应将化学反应分为放热反应和吸热反应
⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液
A.只有②④ B.只有②③⑤ C.只有①②④ D.只有②③⑤
[解析]选A。根据酸分子中能够电离出的H+个数将酸分为一元酸、二元酸,如CH3COOH分子中虽然含有4个H原子,但是只能电离出1个H+,属于一元酸,①错误;金属元素和非金属元素的分类依据是元素的性质,而不是原子的最外层电子数,金属原子最外层电子数一般小于4个,非金属原子最外层电子数一般大于等于4个,但是H原子最外层有1个电子,属于非金属元素,Ge、Sn、Pb最外层有4个电子,Sb、Bi最外层有5个电子,Po最外层有6个电子,它们都是金属元素,③错误;胶体、溶液和浊液三种分散系的本质区别在于分散质的直径不同,⑤错误。
5.(2010·济南模拟)下列说法中正确的是( )。
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.难溶于水的电解质一定是弱电解质
C.离子化合物中可能含有共价键
D.由同种元素组成的物质一定属于纯净物
[解析]选C。大多数金属氧化物属于碱性氧化物,但Al2O3、Na2O2等不是碱性氧化物,大多数非金属氧化物属于酸性氧化物,但CO、NO等不是酸性氧化物,A选项错误;强、弱电解质的本质区别在于是否完全电离,而与溶解性无关,如BaSO4虽然难溶于水,但是溶于水的部分全部电离,属于强电解质,B选项错误;离子化合物中一定含有离子键,可能含有所有类型的共价键,如NaOH中含有离子键和极性共价键,Na2O2中含有离子键和非极性共价键,CH3COONH4中含有离子键、极性共价键、非极性共价键和配位键,C选项正确;由同种元素组成的物质不一定属于纯净物,如金刚石和石墨是不同的物质,它们组成的混合物中只含有碳元素,D选项错误。
4.(2010·榆林模拟)关于一些重要的化学概念有下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④煤的干馏、煤的汽化和液化都属于化学变化;⑤置换反应都属于离子反应。其中正确的是( )。
A.①②⑤ B.①②④ C.②③④ D.③④⑤
[解析]选B。溶液和胶体都属于分散系,由分散剂和分散质组成,都属于混合物,①正确;电解质的强弱与物质的溶解性无关,BaSO4虽然难溶于水,但是溶于水的部分全部电离,属于强电解质,②正确;纯碱是Na2CO3的俗名,属于盐类物质,③错误;煤在隔绝空气的条件下加强热,可分解得到多种物质,这个过程叫煤的干馏,属于化学变化,煤在空气或氧气燃烧时,得到CO、H2等可燃性气体的过程,叫煤的汽化,属于化学变化,煤气化生成的合成气(CO+H2)在不同的催化剂作用下,可以合成甲醇、乙醇、汽油等液态燃料,这叫煤的液化,属于化学变化,④正确;在水溶液中或熔融状态下进行的置换反应属于离子反应,CuO+H2 Cu+H2O不是在该条件下进行的,不属于离子反应,⑤错误。
Cu+H2O不是在该条件下进行的,不属于离子反应,⑤错误。
3.(2010·徐州模拟)用下图表示的一些物质或概念间的从属关系中不正确的是( )。
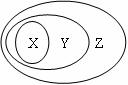
|
|
X |
Y |
Z |
|
A |
氧化物 |
化合物 |
纯净物 |
|
B |
胶体 |
分散系 |
混合物 |
|
C |
金属氧化物 |
碱性氧化物 |
氧化物 |
|
D |
离子化合物 |
电解质 |
化合物 |
[解析]选C。从图中可以看出,Z包含Y,Y包含X。纯净物可以分为单质和化合物,化合物又可以分为酸、碱、盐、氧化物等,符合上述包含关系;分散系是一种混合物,它可以分为溶液、胶体和浊液,符合上述包含关系;氧化物从性质上可以分为酸性氧化物和碱性氧化物,碱性氧化物包括大多数金属氧化物,但是有部分金属氧化物不属于碱性氧化物,如Al2O3属于两性氧化物,Mn2O7属于酸性氧化物,不完全符合上述包含关系;化合物可以分为电解质和非电解质,离子化合物一定是电解质,符合上述包含关系。
2.(2010·楚雄模拟)某化学兴趣小组欲研究H2SO4、NaCl、KCl、Na2CO3、FeCl3、NaOH的性质,对于如何研究,他们设计了两种研究方案:
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐、铁盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
下列说法正确的是( )。
A.常温时少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有酸(H2SO4)溶液和盐(FeCl3)溶液
B.设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀生成,再加入稀硝酸,沉淀不消失,则该溶液中可能含有Ag+
C.按照方案①的分类,属于碱的有Na2CO3、NaOH
D.这两组同学在研究物质时只使用了实验方法、观察法
[解析]选B。铜粉不能溶于稀硫酸,A选项错误;钾盐只有KCl,不溶于稀硝酸的白色沉淀有AgCl和BaSO4,向溶液中加入KCl溶液和稀硝酸,产生的白色沉淀为AgCl,所以溶液中可能含有Ag+,B选项正确;Na2CO3俗名纯碱,属于盐类物质,C选项错误;这两组同学在研究物质时除了使用了实验方法、观察法外,还使用了分类的方法,D选项错误。
1.(2010·上海闸北区模拟)下列有关微粒之间关系和特征描述正确的是( )。
|
选项 |
微粒 |
相互关系 |
特征描述 |
|
A |
C60、C70、C540 |
同位素 |
微粒中只含非极性共价键 |
|
B |
新戊烷、2,2-二甲基丙烷 |
同分异构体 |
常温常压下呈气态 |
|
C |
 Pt、 Pt、 Pt Pt |
同素异形体 |
铂作氨催化氧化时的催化剂 |
|
D |
甲酸、硬脂酸 |
同系物 |
能发生酯化反应 |
[解析]选D。C60、C70、C540是碳元素形成的三种不同的单质,互为同素异形体,只含有碳碳非极性共价键,A选项错误;新戊烷和2,2-二甲基丙烷是同一种物质,B选项错误;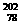 Pt和
Pt和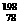 Pt的质子数都是78,中子数分别是124和120,互为同位素,C选项错误。
Pt的质子数都是78,中子数分别是124和120,互为同位素,C选项错误。
21. 选做题,共计12分。本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,每题12分。请选择其中一题作答,并把所选题目对应字母后的方框涂黑。若两题都作答,将按A题评分。
A. 可以由下列反应合成三聚氰胺:
CaO+3C CaC2+CO↑ CaC2+N2
CaC2+CO↑ CaC2+N2 CaCN2+C
CaCN2+C
CaCN2+2H2O=NH2CN+Ca(OH)2
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
。CaCN2中阴离子为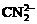 ,与
,与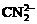 互为等电子体的分子有N2O和
互为等电子体的分子有N2O和
(填化学式),由此可以推知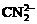 离子的空间构型为 。
离子的空间构型为 。
(2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 ,其中碳氧原子之间的共价键是 (填字母)
A. 2个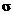 键 B. 2个
键 B. 2个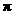 键 C. 1个
键 C. 1个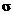 键、1个
键、1个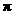 键
键
(3)三聚氰胺(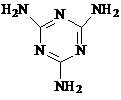 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(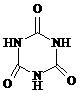 )后,三聚氰酸与三聚氰胺分子相互之间通过
结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过
结合,在肾脏内易形成结石。
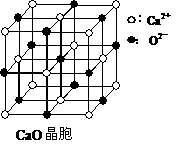
(4)CaO晶胞如下图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ/mol、NaCl 786 kJ/mol。导致两者晶格能差异的主要原因是 。
B. 实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的物理性质如下表。请回答有关问题。
|
化合物 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
|
正丁醇 |
0.810 |
118.0 |
9 |
|
冰醋酸 |
1.049 |
118.1 |
∞ |
|
乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ. 乙酸正丁酯粗产品精制
在干燥的50mL圆底烧瓶中,装入沸石,加入11.5mL正丁醇和9.4mL冰醋酸,再加3-4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应。
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式: 、 。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是: 、 。
Ⅱ. 乙酸正丁酯粗产品的制备
(1)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是 (填字母)。
A. ①②③④ B. ③①④② C. ①④①③② D. ④①③②③
(2)将酯层采用如下图所示装置蒸馏。
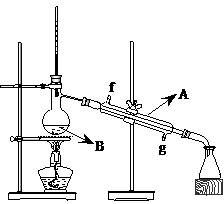
①写出上图中仪器A的名称 。冷却水从 口进入(填字母)。
②蒸馏收集乙酸正丁酯产品时,应将温度控制在 左右。
Ⅲ. 计算产率
测量分水器内由乙酸与正丁醇反应生成的水体积为1.8 mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率 。
20. (10分)某同学对Cu与HNO3的反应进行如下探究。请回答有关问题。
(1)用下图所示装置制取NO,验证U型管中生成的气体是NO的实验方法是 。
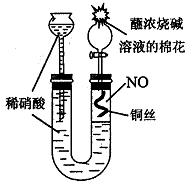
(2)将0.64g Cu全部溶于一定量的浓HNO3中,测得生成气体0.009mol(含NO、NO2和N2O4),共消耗HNO3 0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。
①计算空气中参加反应的O2在标准状况下的体积为 mL。
②计算0.009 mol 混合气体中N2O4的物质的量(写出计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com