
题目列表(包括答案和解析)
7.氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl2相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H2O=HBrO+HCl,下列有关BrCl
的性质的叙述中不正确的是( )
A.是较强的氧化剂
B.Br的化合价为-1价
C.能使湿润的碘化钾淀粉试纸变蓝
D.BrCl与水反应中,BrCl既是氧化剂又是还原剂
6.下表是氧化镁和氯化镁的熔沸点数据:
|
物质 |
氧化镁 |
氯化镁 |
|
熔点/℃ |
2852 |
714 |
|
沸点/℃ |
3600 |
1412 |
请参考以上数据分析,从海水中提取镁,正确的方法是( )
A.海水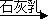 Mg(OH)2
Mg(OH)2
 Mg
Mg
B.海水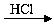 MgCl2溶液MgCl2(熔融)
MgCl2溶液MgCl2(熔融) Mg
Mg
C.海水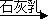 Mg(OH)2
Mg(OH)2 MgO
MgO Mg
Mg
D.海水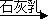 Mg(OH)2
Mg(OH)2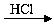 MgCl2溶液→MgCl2(熔融)
MgCl2溶液→MgCl2(熔融) Mg
Mg
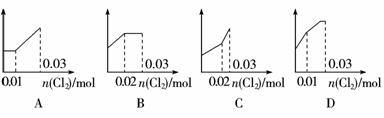
5.(2009年衡水模拟)将0.03 mol Cl2缓缓通入含有0.02 mol H2SO3和0.02 mol HBr的混合液中,则溶液中H+的浓度与通入的氯气的物质的量的关系是下列图中的(纵坐标都表示氢离子的物质的量浓度)( )
4.在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
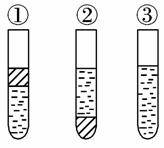
A.①加CCl4 ②加苯 ③加酒精
B.①加酒精 ②加CCl4 ③加苯
C.①加苯 ②加CCl4 ③加酒精
D.①加苯 ②加酒精 ③加CCl4
3.(2010年泰州模拟)湿润的KI?淀粉试纸接触某气体而显蓝色,该气体中可能是( )
①Cl2 ②NO2 ③H2S ④SO2 ⑤HCl ⑥溴蒸气
A.①③④
B.①②⑤
C.①②⑥
D.②④⑤
2.(2008年广东卷)海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是 ( )
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.利用潮汐发电是将化学能转化为电能
1.食用加碘食盐可以提高国民身体素质和智力素质。下列关于加碘食盐的说法中正确的是( )
A.加碘食盐中的碘可能是碘化钾和碘酸钾的混合物
B.食盐中的碘可以用淀粉检验其是否存在
C.加碘食盐在空气中久置,碘的含量会降低
D.加碘食盐最好在刚放入菜的时候加入,这样可以
使碘元素渗透到菜中,便于吸收
12.(2008年广东卷)铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是__________。
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:
2Cu2O+Cu2S
 6Cu+SO2↑,反应的氧化剂是____________。
6Cu+SO2↑,反应的氧化剂是____________。
(3)SO2尾气直接排放到大气中造成环境污染的后果是___________;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称____________。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是____________(填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主要成分是碱式碳酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ对;有 |
|
B |
铜表面易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ对;有 |
|
C |
铁比铜活泼 |
铆在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ对;无 |
11.(2009年靖江模拟)“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如下图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物。已知:蓝色的“北”是液态O2,红色的“欢”是固态非金属单质,1 mol G可与1 mol“您”恰好反应生成1 mol H,F的溶液可与A反应生成酸M、酸N和E的溶液,C高温煅烧可制得A,此反应是工业上制取酸M的基础反应。
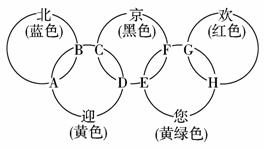
请回答下列问题:
(1)“京”是____________,“欢”的同素异形体是____________。
(2)写出F的溶液与A反应生成酸M、酸N和E的溶液的化学方程式:_______________,该反应为氧化还原反应,还原产物为____________。
(3)工业上以C为基础原料,制取酸M产生的工业尾气直接排放到大气中会造成环境污染,处理该尾气中得到一种化肥,写出该肥料的化学式:____________。
10.市面上一些很白的粉条,可能是经过SO2漂白的食品,这种粉条食用后对人体有危害。
某化学兴趣小组的同学通过下列方法对疑似用SO2漂白的粉条中残留的SO2含量进行研究:
实验课题:粉条中残留SO2的定量测定
实验原理:5SO2+2KMnO4+2H2O=2MnSO4+K2SO4+2H2SO4
2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O
操作流程:安装蒸馏、吸收装置→SO2的产生与吸收→转移褪色→Na2SO3标准溶液滴定
实验装置: C中盛有200 g粉条;D、E、F各盛装100 mL浓度为100×10-3mol/L的KMnO4溶液(H2SO4酸化)。
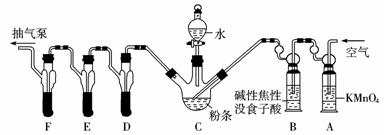
请回答下列有关问题:
(1)实验时要对C装置进行加热,其目的是____________________。
(2)检查上述装置气密性的方法是__________________________ 。
(3)实验过程中,用抽气泵抽气的目的是_________________________。
(4)A中盛装KMnO4溶液是为了除去空气中可能含有的____________;B中盛装碱性焦性没食子酸溶液的作用是______________________;如去除B装置,则实验中测得的SO2含量将____________。
(5)收集D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25 mL,用浓度为5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液1100 mL,则该粉条中硫化物(以SO2计)的含量为____________mg/kg.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com