
题目列表(包括答案和解析)
4.(2009年合肥质检)使56 L CO2气体迅速通过Na2O2固体后得到448 L气体(标准状况下),这448 L气体的质量为( )
A.88 g
B.64 g
C.82 g
D.62 g
3.(2009年潍坊测试)
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是
( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
1.(2009年上海卷)92 g金属钠投入到足量的重水中,则产生的气体中含有
( )
A.02 mol 中子
B.04 mol 电子
C.02 mol 质子
D.04 mol 分子
2为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3):选用适量NaOH溶液
B.NaHCO3溶液(Na2CO3):应通入过量的CO2气体
C.Na2O2粉末(Na2O):将混合物在空气中加热
D.Na2CO3溶液(Na2SO4):加入适量的Ba(OH)2溶液,过滤
12.(探究创新题)某中学化学兴趣小组想测定饱和氯水的pH,并进行氯水的氧化性和制漂白剂等实验。他们使用如下图装置制取较多量的饱和氯水,回答:
(1)写出仪器的名称:A____________,B____________。
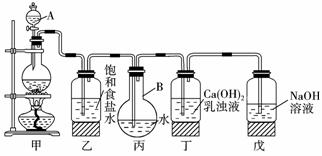
(2)写出甲、丁装置中发生反应的化学方程式
甲:____________ 。
丁:____________ 。
(3)制取结束时,氯水已饱和的现象是____________ ,丙、乙中液体含量最多的微粒分别是_______________、_______________。
 (4)漂白粉在溶液中存在下列平衡:ClO-+H2O
HClO+OH-。下列措施能提高漂白效果的是____________。
(4)漂白粉在溶液中存在下列平衡:ClO-+H2O
HClO+OH-。下列措施能提高漂白效果的是____________。
A.加水稀释 B.通入CO2
C.加入适量盐酸 D.加入少量NaOH
E.加少量白醋
(5)为使制取过程简便并保证制得的氯水纯净,有同学提出如下建议:
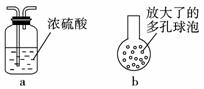 ①在乙和丙之间增加右图中的a装置,你认为有无必要- (填“有”或“无”)。
①在乙和丙之间增加右图中的a装置,你认为有无必要- (填“有”或“无”)。
②若撤去乙,直接将甲和丙相连,你认为是否可行?_______________,理由是____________ 。
③在丙的长导管下口处,接右图中的b,可以提高氯气的吸收效果。原因是____________ 。
11.(2009年潍坊模拟)饱和氯水与石灰石的反应是制取较浓的HClO溶液方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;②过滤,将滤液滴在有色布条上,发现其漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验;第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量气泡;第三份加热,看到溶液变混浊且有大量无色气体产生;经检验,上述实验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因____________ 。
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份____________ 。
第二份____________ 。
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为(写化学式)- 。
10.在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知E溶液是无色的,请回答:
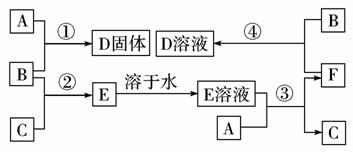
(1)写出下列物质的化学式:
A____________,B____________,C____________。
(2)反应①的化学方程式为:____________ 。
(3)反应③的化学方程式为:____________ 。
(4)反应④的化学方程式为:____________ 。
9.为了探究新制备的饱和氯水的组成和性质而进行了科学实验:先观察了氯水的外观性质以后,再用胶头滴管将新制备的饱和氯水逐滴滴入含有酚酞的红色NaOH溶液中,边滴边振荡,并连续观察现象,结果溶液的红色逐渐褪去,得无色溶液。
(1)请写出新制备的饱和氯水中含有氯元素的物质的化学式:_______________。
(2)若不再进行更多的实验,请说明能证明氯水中含有Cl2的主要依据:___________ 。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,
请用简要的文字说明之:
①____________ 。
②____________ 。
(4)他们要通过科学实验探究溶液的红色褪去的原因是上述原因中的①还是②。
[实验步骤]
①取试管内的无色溶液3 mL盛于另一支洁净的试管中;
②____________ ,振荡试管。
[实验现象及结论]
①若____________,则证明溶液红色褪去的原因是①而不是②;
②若____________,则证明溶液红色褪去的原因是②而不是①。
(5)为了从新制氯水中制得较高浓度的HClO,可向氯水加入的试剂是____________。
A.CaCO3 B.NaHSO3
C.H2SO4 D.Ca(OH)2
8.(2009年济南模拟)某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( ) 
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成棕黄色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯
中,至溶液显酸性,结果有Cl2生成
7.下列有关化学反应过程或实验现象的叙述中,正确的是( )
A.氯气的水溶液可以导电,说明氯气是电解质
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
D.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后溶液的红色褪去,说明BaCl2溶液具有酸性
6.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-和ClO3-的浓度之比为1∶3,则Cl2与NaOH反应时,被还原的氯元素与被氧化的氯元素物质的量之比为( )
A.21∶5
B.11∶3
C.3∶1
D.4∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com