
题目列表(包括答案和解析)
12.(2009年泰安一模)某固体混合物,其中可能含有CuSO4、BaCl2、Na2CO3、K2SO4,根据下表所列实验操作及现象,试分析混合物的组成并回答有关问题:
|
|
实验操作 |
实验现象 |
|
① |
将固体混合物放入水中并不断搅拌 |
得到白色沉淀和无色透明溶液 |
|
② |
加入硝酸溶液,使溶液pH=2 |
沉淀完全消失,产生无色气体,溶液澄清 |
|
③ |
继续加入稀硫酸,使溶液pH=1 |
溶液中出现白色沉淀 |
(1)原混合物中肯定存在的是____________ ,肯定不存在的是____________ 。
(2)用离子方程式表示上述实验过程中肯定发生的化学变化:
____________ ;
____________ ;
11.(探究创新题)(Ⅰ)下列各组离子在指定溶液中一定能大量存在的是____________。
①pH=1的溶液中:Fe2+、Al3+、HCO3-、MnO4-
②能与金属铝反应放出氢气的溶液中:K+:NO3-、Cl-、NH4+
③含有大量OH-的无色溶液中:Na+、Cu2+、AlO2-、SiO32-
④常温下水电离出的[H+]=10-10mol·-1L的溶液中:Na+、Cl-、S2-、SO32-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
⑥滴加无色酚酞试液后变红色的溶液中:Na-、CO32-、K+、ClO-、AlO2-
(Ⅱ)某溶液可能是由Mg2+、Ba2+、Al3+、K+、Cl-、SO42-、HCO3-、NO3-中的几种组成,进行如下实验:
①取样后在溶液中加入足量NaOH溶液,生成的沉淀会部分溶解。
②将①所得的混合液分成两份,在一份中加入足量的稀H2SO4溶液,最终得不到澄清溶液;在另一份中加入足量的稀HNO3溶液进行酸化后加入AgNO3溶液,无沉淀产生。
根据实验回答下列问题:
(1)该溶液中一定存在的离子是____________ ;
可能存在的离子是____________ ;
一定不存在的离子是____________ 。
(2)写出Ⅱ中沉淀部分溶解时的离子方程式:____________ 。
(3)如要进一步确定可能存在的离子是什么?应追加的实验操作是:____________。
10.人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内。当胃酸过多时就会出现“咯酸水”、“烧心”、“胃部隐隐作痛”等症状,严重时会降低食欲,引起消化不良等。当胃酸过多时,医生通常用“小苏打片”、“胃舒平”给病人治疗(小苏打片的成分是碳酸氢钠,胃舒平中则含有氢氧化铝)。
(1)写出用“小苏打片”治疗胃酸过多时反应的离子方程式:
____________ 。
(2)有人用土法治疗胃酸过多病,方法是:将鸡蛋皮洗净、烤焦、磨细服用。据说这种疗法效果还不错。请用学过的知识分析其中的化学道理。____________
____________ 。
(3)如果病人同时患有胃溃疡,此时最好服用胃舒平,反应的离子方程式为:____________
____________ 。
(4)氢氧化钠的也能中和胃酸,可以服用少量氢氧化钠来治疗胃酸过多病吗?____________
____________ 。
(5)写出NaOH溶液分别与“小苏打”、“胃舒平”溶液反应的离子方程式:____________
____________ 。
9.只用一种试剂即可除去下列各物质中的杂质(括号内为杂质),试写出所用试剂及有关反应的离子方程式。
(1)BaCl2(HCl) 选用试剂____________ ,
离子方程式____________ 。
(2)CO2(SO2) 选用试剂____________ ,
离子方程式____________ 。
(3)NaCl(Na2SO4) 选用试剂____________ ,
离子方程式____________ 。
(4)FeCl2(FeCl3) 选用试剂____________ ,
离子方程式____________ 。
(5)Na2CO3(NaHCO3) 选用试剂____________ ,
离子方程式____________ 。
8.下列各组中的物质相互反应时,若两种试剂的量发生改变,不可用同一个离子方程式表示的是( )
A.氯化铝和氨水
B.硫酸钠和氢氧化钡
C.碳酸氢钙和氢氧化钠
D.碳酸钠溶液和盐酸
7.(2010年山东山师附中)若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,可能大量共存的是( )
A.NH4+ NO3- CO32- Na+
B.Na+ Ba2+ Mg2+ HCO3-
C.Cu2+ Fe3+ K+ Cl-
D.NO3- K+ AlO2- OH-
6.(2009年临沂模拟)某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的离子是( )
A.Al3+、Mg2+、I-、SO32-
B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I-
D.Al3+、CO32-、Br-、SO32-
5.M和N两溶液分别含有下列十二种离子中的五种和七种离子:K+、Na+、H+、NH4+、Fe3+、Al3+、Cl-、OH-、NO3-、S2-、CO32-、SO42-。已知两溶液所含离子各不相同,N溶液里的阳离子只有两种,则N溶液里的阴离子一定有( )
A.OH-、CO32-、S2-
B.S2-、Cl-、SO42-
C.CO32-、NO3-、S2-
D.Cl-、SO42-、NO3-
4.(2009年江苏卷)下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:
ClO-+CO2+H2O=HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:
MnO2+2H++2Cl-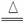 MN2++Cl2↑+2H2O
MN2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO2-4+3Cl-+H2O+4H+
3.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③05 mol·-1L所有一元酸中氢离子浓度都是05 mol·-1L
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电
A.①③⑤⑥
B.②④⑤⑥
C.只有⑤
D.只有⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com