
题目列表(包括答案和解析)
10.(2009年济南一模)请你协助化学兴趣小组的同学完成如下实验,并回答相关问题。实验目的:比较等体积0.5 mol/L硫酸、1 mol/L盐酸、1 mol/L醋酸分别与金属反应生成氢气的速率和体积。实验用品:仪器(略)、药品(除给定的三种酸溶液外,在Na、Mg、Fe三种金属中选择最合适的一种,并说明理由)。选择的金属是____________,不选其他两种金属的理由是____________ 。
实验步骤:
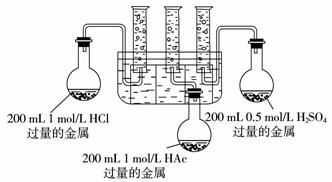
(1)甲同学设计的实验装置如上图所示。
(2)乙同学认为该装置不能控制三个反应在同一时间发生,并作了相应的改进。你认为乙同学改进的措施是:____________ ____________ 。
(3)按改进后的装置进行实验,观察现象并得出相关结论。实验现象及结论:____________
____________ 。
(4)反应开始时的速率:v(H2SO4)____________v(HCl)____________v(HAc)(用“=”、“<”或“>”填空,下同),反应进行一段时间后的速率:v(H2SO4)<v(HCl)____________v(HAc)。
(5)最终得到的氢气体积:V(H2/H2SO4)____________V(H2/HCl)____________V(H2/HAc)。
问题讨论:
(6)对结论“(4)”、“(5)”中盐酸和醋酸的异同,你的解释是____________ 。
9.对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25 ℃时有HA=H++A-,则K=c(H+)·c(A-)/c(HA)式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃):
|
酸 |
电离方程式 |
电离平衡常数K |
|
CH3COOH |
CH3COOH=CH3COO-+H+ |
1.76×10-5 |
|
H2CO3 |
H2CO3=H++HCO3-
HCO3-=H++CO32- |
K1=4.31×10-7 K2=5.61×10-10 |
|
H2S |
H2S=H++HS HS-=H++S2- |
K1=9.1×10-8 K2=1.1×10-12 |
|
H3PO4 |
H3PO4=H++H2PO4-
H2PO4-=H++HPO42- HPO2-4=H++PO43- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值____________(填“增大”“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?____________ 。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是____________,最弱的是____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是______________,产生此规律的原因是____________ ____________ 。
8.下列实验事实不能证明醋酸是弱酸的是( )
A.常温下,醋酸溶液能与石灰石反应生成CO2
B.常温下,测得0.1 mol·-1L醋酸溶液的pH=4
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
7.对氨水溶液中存在的电离平衡NH3·H2O=NH4++OH-,下列叙述正确的是( )
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中c(OH-)增大
C.加入少量浓NaOH溶液,电离平衡向正反应方向移动
D.加入少量NH4Cl固体,溶液中c(NH4+)增大
6.甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
①甲中由水电离出来的H+的物质的量浓度是乙的1/10
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两种酸的体积,10V(甲)>V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍
A.①②④正确
B.①③正确
C.②④正确
D.只有①正确
5.在二氧化碳的水溶液中存在着如下平衡:
CO2(g)=CO2(aq)
CO2(aq)+H2O=H2CO3(aq)
H2CO3(aq)=H+(aq)+HCO3-(aq)
HCO3-(aq)=H+(aq)+CO32-(aq)
下列有关说法正确的是( )
A.水中溶解的二氧化碳的浓度,夏天比冬天高
B.如果海水略呈碱性,海水中二氧化碳的浓度比纯水高
C.气压升高,水中c(HCO3-)增大
D.常温下,二氧化碳的水溶液中,由水电离的c(H+)与c(OH-)的乘积等于1×10-14
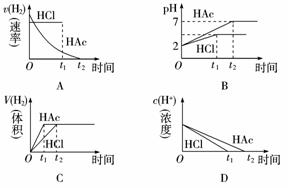
4.向体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.28 g Fe,则下图中的曲线符合反应事实的是( )
3.(2009年汕头质检)同一温度下,强电解质溶液a,弱电解质溶液b,金属导体c三者的导电能力相同,若升高温度后,它们的导电能力强弱的顺序是( )
A.a=b=c
B.b>a>c
C.c>a>b
D.b>c>a
2.(2009年肇庆质检)在25 ℃时的醋酸溶液,若采用下列不同的措施:①加入NaOH固体;②加入CaCO3固体;③加等体积的水稀释;④加热醋酸溶液使温度上升10 ℃;⑤加入醋酸钠固体;⑥加入盐酸。其中能促进醋酸电离的有( )
A.①③④
B.①②③④
C.①③④⑤
D.①②③④⑤
1.下列关于电解质的说法正确的是( )
A.NaHCO3溶于水,其电离方程式为:NaHCO3=Na++HCO3-, HCO3-=H++CO32-
B.SO2的水溶液能导电,所以SO3为电解质
C.浓度均为1 mol·-1L的NaCl和MgSO4溶液,导电能力相同
D.NaCl晶体不导电是由于NaCl晶体中不存在离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com