
题目列表(包括答案和解析)
6.现有CuO和Fe2O3组成的混合物a g,向其中加入2 mol·-1L的硫酸溶液50 mL,恰好完全反应。若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为( )
A.1.6 a g
B.(a-1.6) g
C.(a-3.2) g
D.1.6 g
5.CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是( )
A.将两种样品分别溶于硝酸,通过所产生的气体区别
B.将两种样品分别溶于硝酸,通过溶液的颜色区别
C.取两种同质量的样品分别高温灼烧,通过残留固体的质量区别
D.取两种同质量的样品分别高温灼烧,通过残留固体的颜色区别
4.已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
|
加入试剂 |
稀硫酸 |
浓硫酸、加热 |
稀硝酸 |
浓硝酸 |
|
实验现象 |
红色固体和 蓝色溶液 |
无色气体 |
无色气体和 蓝色溶液 |
红棕色气体 和蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物是( )
A.Cu
B.Cu2O
C.一定有Cu,可能有Cu2O
D.一定有Cu2O,可能有Cu
3.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是用电解熔融的氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
2.人类历史上大量生产和使用铝、钛、铁、铜四种金属单质的时间顺序是( )
A.铜、铁、铝、钛
B.铁、铝、铜、钛
C.铜、铁、钛、铝
D.铁、铜、铝、钛
1.(2009年启东模拟)下列说法中不正确的是( )
A.人类历史上使用最早的合金是青铜
B.司母戊鼎是我国目前已发现的最重的青铜器
C.目前世界上使用量最大的合金是铝合金
D.目前世界上用途最广的合金是钢
12.(2009年梁丰质检)已知Ksp(AgCl)=c(Ag+)·c(Cl-)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,某同学通过实验验证醋酸银(CH3COOAg)的Ksp,实验中用了如下反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq),该学生将已知质量的铜片加入到CH3COOAg饱和溶液中,待充分反应后,将铜片冲洗干净、重新称量。
(1)CH3COOAg的Ksp=2.0×10-3,没反应前铜片的质量为23.4 g,将铜片放在100 mL的CH3COOAg饱和溶液中,此饱和溶液中没有CH3COOAg固体,通过计算说明充分反应后铜片中铜的质量为何值时,CH3COOAg的Ksp得到证实。
(2)为什么做此实验时CH3COOAg饱和溶液中必须没有CH3COOAg固体?
11.(2009年海南模拟)如下图所示,横坐标为溶液的pH值,纵坐标为Zn2+离子或
Zn(OH) 42-,离子物质的量浓度的对数,回答下列问题。
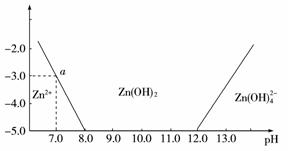
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:____________ 。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=-____________________________________ 。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是____________ 。
(4)往100 L 1.00 mol·-1L ZnCl2溶液中加入NaOH固体至pH=6,需NaOH____________ mol。
(5)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25 ℃时,PbCl2固体在盐酸中的溶解度如下:
|
c(HCl)/(mol·-1L) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
c(PbCl2)/(mol·-1L)×10-3 |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是____________(填字母序号)
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·-1L盐酸中溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离子的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
10.已知常温下,FeS的Ksp=6.25×10-18 mol2·L-2,ZnS的Ksp=1.2×10-23 mol2·L-2,H2S的饱和溶液中[H+]与[S2-]之间存在如下关系:[H+]2·[S2-]=1.0×10-22 mol3·L-3。试回答下列有关问题:
(1)向ZnS的饱和溶液中:①加入少量固体Na2S,则溶液中[S2-]____________(填“变大”、“变小”或“不变”,下同);②加入ZnS固体,则溶液中[S2-]____________;③加入FeS固体,则溶液中[Zn2+]____________。
(2)在常温下,将适量的FeS投入到氢硫酸饱和溶液中,欲使溶液中[Fe2+]达到1 mol/L,应调节溶液的pH=__________(已知:lg2=0.3)。
9.氧化还原滴定法是以氧化还原反应为基础的滴定分析方法,其中一种叫高锰酸钾法。由于在微酸、 中性和弱碱性溶液中,MnO4-被还原为棕色不溶物MnO2,使溶液混浊而妨碍滴定终点的观察,因此高锰酸钾法通常在较强的酸性溶液中进行。
(1)酸化高锰酸钾时,能不能使用盐酸____________(答“能”或“不能”),理由是(回答“不能”,此问作答,回“能”,此空不填,下同)____________;能否使用HNO3____________(答“能”或“不能”),理由是:____________ 。
(2)KMnO4标准溶液常用还原物质来标定。常用的还原物质为Na2C2O4等。其标定反应向下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
滴定开始时,是否需要滴加指示剂?____________(填“是”或“否”),理由是____________ 。
(3)用KMnO4标准溶液在酸性溶液中可测定H2O2样品中H2O2的含量,反应如下:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O。
①温度不变,反应开始较慢,随着反应的进行,反应速度明显加快,可能的原因是____________ 。
②该反应中H2O2为____________剂。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com