
题目列表(包括答案和解析)
4.(2009年南京调研)在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后铁完全反应,溶液中不存在Fe3+,同时析出0.1 mol Ag。则下列结论中不正确的是( )
A.反应后溶液中Cu2+与Fe2+的物质的量之比为1∶2
B.氧化性:Ag+>Cu2+>Fe3+>ZN2+
C.含Fe3+的溶液可腐蚀铜板
D.1 mol Fe可还原2 mol Fe3+
3.常温下把铁片投入到下列溶液中,铁片溶解,溶液质量增加,但是没有气体产生的是( )
A.硫酸铁溶液
B.浓HNO3
C.盐酸
D.硫酸锌溶液
2.在下列有FeCl3溶液参加的反应中,与Fe3+水解有关的反应是( )
①FeCl3与Cu反应 ②FeCl3与H2S反应 ③FeCl3与KI反应 ④FeCl3滴入沸水中 ⑤FeCl3与NaHCO3反应 ⑥FeCl3溶液中滴入石蕊试液
A.③④⑤⑥
B.③④⑤
C.④⑤⑥
D.②③⑤
1.(2010年潍坊测试)南极考察队在印度洋发现了一种不寻常的鱼,它的血液像水一样无色透明。研究发现这种鱼的血液中某种元素的含量是其他鱼血液中的十分之一。这种元素是( )
A.Cu
B.Ag
C.Fe
D.Pb
12.(2009年衡水模拟)为了探究铜与浓硫酸的反应,某研究性学习小组做了如下实验:
①在放有铜片的圆底烧瓶中加入10 mL浓硫酸,加热煮沸10 min(如上图所示)后,所得固体分离除去未反应的铜片,再经水洗仍有大量黑色不溶物。
②取少量不溶物,向其中加入几滴浓硝酸,产生大量红棕色气体。
③取少量不溶物,向其中加5 mL酒精,充分振荡后,静置、过滤,把滤液移入盛有水的小试管中,振荡,出现浑浊。
④取少量不溶物,向其中加入3 mL氨水,振荡,溶液呈无色,在空气中静置,溶液变为深蓝色。
⑤取少量不溶物,向其中加入浓盐酸并加热,沉淀几乎全部溶解。
为了解释上述现象,学习小组通过查阅资料了解到:
|
a.铜与浓硫酸反应的不溶性副产物可能有:CuS、Cu2S、Cu2O、S等物质; b.CuS和Cu2S都能溶于热的浓盐酸; c.Cu2O能溶于氨水生成无色的[Cu(NH3)2]+, [Cu(NH3)2]+在氨水中被空气中的氧气氧化成深蓝色的[Cu(NH3)4]2+。 |
回答下列问题:
(1)第②步操作要注意的问题是____________ ;对比①②两步操作中的现象,你能得到的结论是____________ 。
(2)第③步操作中出现的沉淀是____________ ,请解释出现这一现象的原因____________ 。
(3)写出④步涉及的离子方程式____________ 。
(4)综合分析铜与浓硫酸的反应,生成的不溶物是____________。
11.试设计一个方案,在用廉价的原料和每种原料只用一次的条件下,分三步从含有Fe3+、Cu2+、Cl-和NO3-的废液中,把Fe3+转化为绿矾回收;把Cu2+转化为Cu回收。
各步反应加入的原料依次是____________ 。
各步反应的离子方程式是:
(1)____________ ;
(2)____________ ;
(3)____________ 。
10.某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为:
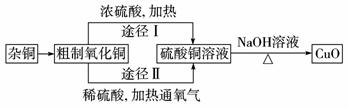
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是____________。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:____________
____________ 。
(3)有同学指出,由CuSO4溶液到生成CuO少了一个环节,即应先生成Cu(OH)2沉淀,过滤洗涤后再加热分解Cu(OH)2得CuO。以下说法不可能成为减少该环节的理由的是____________。
A.CuO比Cu(OH)2颗粒粗大,更易于过滤从溶液中分离
B.Cu(OH)2分解温度较低,加热其浊液即可使其分解
C.干态下分解Cu(OH)2,温度难以控制,可能因温度过高导致CuO进一步分解生成Cu2O
D.过滤分离出的CuO不需洗涤就已非常纯净
9.(2009年广东卷)已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验,探究该混合金属粉末中铁、铜元素的存在。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1 mol·-1L硫酸、2 mol·-1L硝酸、2 mol·-1L NaOH溶液、20% KSCN溶液。
完成以下实验探究过程:
(1)提出假设
假设1 该混合金属粉末中除铝外还含有____________元素;
假设2 该混合金属粉末中除铝外还含有____________元素;
假设3 该混合金属粉末中除铝外还含有Fe、Cu元素。
(2)设计实验方案
基于假设3,设计出实验方案。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
|
编号 |
实验操作 |
预期现象与结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
8.(2009年豫南模拟)在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化,根据上述现象,确定下面结论正确的是( )
A.不溶物一定是Cu
B.不溶物一定含铜,但不一定含铁
C.不溶物一定是Fe
D.溶液中一定含有Fe2+,一定不含Cu2+
7.下列叙述正确的是( )
A.碳纤维增强复合材料可用于人体组织中韧带的制作
B.氮化硅陶瓷是新型无机非金属材料
C.银、铜、铁都是有色金属材料
D.碳化硅陶瓷具有压电效应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com