
题目列表(包括答案和解析)
2.下列说法正确的是 ( )
①二氧化硅是酸性氧化物,它可以跟碱反应,但不能与任何酸反应
②根据反应SiO2+CaCO3CaSiO3+CO2↑可推知硅酸酸性比碳酸强
③二氧化碳通入硅酸钠溶液中可以制得硅酸
④二氧化硅常被用来制造光导纤维
A.①② B.②③
C.③④ D.①④
答案:C
1.下列物质中,不含有硅酸盐的是 ( )
A.水玻璃 B.硅芯片
C.黏土 D.普通水泥
答案:B
18.(2009·天津)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列,从海水中提取食盐和溴的过程如下:
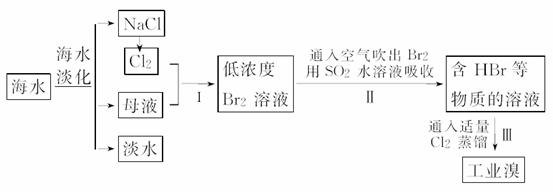
(1)请列举海水淡化的两种方法:______________、____________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为________________________________________________________________________
________________________________________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为______________________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是______________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料;Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
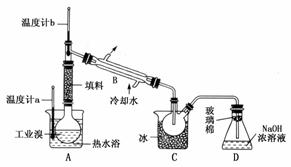
请你参与分析讨论:
①图中仪器B的名称:________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是________________________________________________________________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________________________________________________________________________。
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________________________________________________________________。
解析:(1)海水淡化的方法主要有蒸馏法、离子交换法。
(2)电解NaCl溶液可生成H2、Cl2、NaOH,若将Cl2通入到NaOH溶液中可得到NaClO。
(3)步骤Ⅰ是为了富集海水中的溴。
(4)反应为SO2+Br2+2H2O===SO+2Br-+4H+,因生成强酸会对设备产生严重的腐蚀。
(5)②Br2会腐蚀橡胶。③控制温度(Br2的沸点为59℃)。④C中收集的是液溴(红棕色),通入Cl2后,Cl2+2NaBr===Br2+2NaCl,可用分液法操作分离。
答案:(1)蒸馏法、电渗析法、离子交换法(任填两种,其他合理答案即可)
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O===4H++SO+2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度,并收集59℃时的馏分 ④深红棕色 分液(或蒸馏)
17.(2009·常州测试)饱和氯水与石灰石的反应是制取较浓的HClO溶液方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生;
经检测,上述实验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因________________________________________________________________________
________________________________________________________________________。
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份______________________________________________________。
第二份_____________________________________________________________。
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为(写化学式)__________________ ________________________________。
答案:(1)在饱和氯水中存在如下平衡:Cl2+H2OHCl+HClO,加入的过量CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
(2)Ca+HCO+OH-===CaCO3↓+H2O
HCO+H+===CO2↑+H2O
(3)HClO、Ca(HCO3)2、CaCl2
16.(2009·蚌埠模拟)(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,这是因为_________________________________,
反应的离子方程式是___________________________。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,这是因为________________________________________________________________________,
反应的离子方程式是____________________________________________。
(3)对比(1)和(2)实验所得的结果,将Cl-、I-、SO2按还原性由强到弱顺序排列为________________________________________________________________________。
解析:(1)氯气氧化KI生成碘单质,碘使淀粉变蓝。
(2)碘被SO2还原。
(3)由(1)、(2)知三者还原性强弱:SO2>I->Cl-。
答案:(1)I-被氧化成I2,I2使淀粉变成蓝色
2I-+Cl2===I2+2Cl-
(2)I2被SO2还原成I-
I2+SO2+2H2O===2I-+SO+4H+
(3)SO2>I->Cl-
15.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液。经测定ClO-与ClO的物质的量浓度之比为1?3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
A.21:5 B.11:3
C.3:1 D.4:1
解析:根据题意Cl2与NaOH反应,Cl2既被氧化又被还原,被氧化的氯元素的产物ClO-、ClO的物质的量之比为1?3,被还原的氯元素的产物是Cl-,可根据氧化还原反应得失电子守恒进行求解。若反应中生成1 mol ClO-,氯元素失去1 mol电子,生成3 mol ClO,失去15 mol电子,即共失去16 mol电子,则必有16 mol的氯原子被还原成Cl-。所以,被还原的氯元素与被氧化的氯元素的物质的量之比为16 mol?(1 mol+3 mol)=4?1。
答案:D
14.(2009·黑龙江哈尔滨五中高三第一次月考)已知BrCl能发生下列反应:nBrCl+2M=MCln+MBrn(M为+n价的金属元素),BrCl+H2O=HCl+HBrO,以下推论不正确的是
( )
A.BrCl具有和卤素单质相似的化学性质
B.BrCl和M反应时,BrCl只作氧化剂
C.BrCl和NaOH溶液反应生成NaCI、NaBrO两种盐
D.将BrCl跟FeSO4溶液反应,溶液会变成无色
答案:D
13.(2008·江苏盐城5月)ClO2是一种消毒杀菌效率高、二次污染小的处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO42ClO2↑+2CO2↑+2H2O+K2SO4下列说法正确的是 ( )
A.KClO3在反应中得电子
B.ClO2是氧化产物
C.H2C2O4在反应中被还原
D.1 mol KClO3参加反应有2 mol电子转移
解析:反应中KClO3为氧化剂,得电子被还原,H2C2O4为还原剂,失电子被氧化。KClO3中Cl从+5价变为+4价,1 mol KClO3参加反应转移1 mol电子。
答案:A
12.(2009·山东)下列关于氯的说法正确的是 ( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.C、Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2可用排饱和食盐水集气法收集
D.1.21 L Cl2含有1.78 NA个质子(NA表示阿伏加德罗常数)
解析:A中Cl2亦可作还原剂,如Cl2+H2O===HCl+HClO;B中同一元素的不同核素的化学性质相同;D中Cl2未注明状况。
答案:C
11.(2009·广东)广东正在建设海洋强省。下列说法不正确的是 ( )
A.从海带中提取碘单质的过程涉及氧化还原反应
B.往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输
C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的
D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属
解析:D选项中B为非金属。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com