
题目列表(包括答案和解析)
2.下列有关化学用语或名称表达正确的是 ( )
 A.Mg的原子结构示意图:
A.Mg的原子结构示意图:
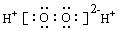 B.H2O2的电子式:
B.H2O2的电子式:
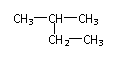
C. 的名称:2-乙基丙烷
D. CO32-水解的离子方程式: CO32- +H2O  HCO3-+ OH-
HCO3-+ OH-
1.生活是化学的源泉,下列有关生活中的化学叙述不正确的是 ( )
A.铁强化酱油可通过膳食补充人体所需的铁元素
B.变质的植物油有难闻的特殊气味,是由于植物油发生了水解反应
C.一定浓度的双氧水可用于伤口的消毒
D.在采煤工业上,爆破时把干冰和炸药放在一起,既能增强爆炸威力,又能防止火灾
18.(2009·江苏)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%-103.0%)的主要流程如下:
盐酸 氢氧化钙 盐酸



工业CaCO3→→→→→


滤渣 CaCl2·2H2O
(1)除杂操作是加入氢氧化钙,调节溶液的PH为8.0-8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是______________________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③_____________________________________。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有__________________________________。
②计算上述样品中CaCl2·2H2O的质量分数为______________________________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有______________________________________________;
________________________________________________________________________。
解析:第(1)问中若Fe(OH)3未沉淀完全则溶液中应含有Fe3+,但浓度很小所以通常选用KSCN而不用OH-检测;第(2)问中调节pH使之显弱酸性主要是为了防止Ca2+形成溶解度较小的Ca(OH)2、CaCO3;由Ag+-Cl-可知滴定溶液中,n(CaCl2·2H2O)=n(Cl-)=×0.05000 mol·L-1×20.39×10-3 L,
所以w(CaCl2·2H2O)=
×100%=99.9%。
答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,说明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中的CO2
(3)①酸式滴定管 ②99.9% ③样品中有少量的NaCl;少量CaCl2·2H2O失水
17.(2008·四川理综,26)某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”)。
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在 的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色。
|
肯定存在 的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在 的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是__________。
解析:混合物溶于水得到无色溶液,说明混合物中没有CuSO4;焰色反应呈黄色,说明含有Na2SO4;白色沉淀加入稀盐酸,沉淀完全溶解,并放出气体说明不溶于HCl的白色沉淀BaSO4和AgCl,则白色沉淀是MgCO3,原溶液中没有Ba(NO3)2和AgNO3。
答案:(1)
|
无 |
CuSO4 |
溶液无色,而CuSO4溶液为蓝色 |
(2)
|
Na2SO4 |
无 |
钠的焰色反应呈黄色 |
(3)
|
MgCO3 |
Ba(NO3)2、AgNO3 |
MgCO3沉淀溶于稀盐酸,有气体放出;如有Ba(NO3)2,生成的BaSO4沉淀不溶于盐酸;如有AgNO3,生成的沉淀在盐酸中不消失 |
(4)Al2(SO4)3[来源:]
16.(2008·河北唐山联考)某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO、MnO、CO、SO中的若干种离子组成,取溶液进行如下连续实验:
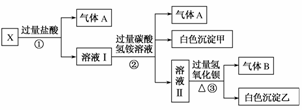
(1)气体A的成分是(填化学式,下同)________,气体B的成分是________。
(2)X溶液中一定存在的离子是__________________。
(3)写出步骤①发生反应的所有离子方程式__________________________________。
(4)写出步骤②形成白色沉淀甲的离子方程式__________________________________。
(5)通过上述实验,溶液X中还有未完全确定的离子是________;只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是_________________________________(简述所加试剂及理由)。
解析:由于溶液是无色的,所以排除MnO的存在;溶液X中加入HCl有气体生成,说明有CO的存在,生成气体A为CO2;CO的存在排除了Ag+、Ba2+、Al3+的存在;第②步继续向反应后的溶液中加入NH,反应既生成气体,又生成沉淀,所以证明原溶液含有AlO,AlO在第一步加入HCl时发生反应AlO+4H+===Al3++2H2O,生成的Al3+和HCO发生相互促进水解反应;Al3++3HCO===Al(OH)3↓+3CO2↑;第③步继续加入Ba(OH)2,生成白色沉淀,可能含有BaCO3或BaSO4中的一种或两种,用盐酸检验。
答案:(1)CO2 NH3
(2)CO、AlO、Na+
(3)CO+2H+===H2O+CO2↓ AlO+4H+===Al3++2H2O
(4)Al3++3HCO===Al(OH)3↓+3CO2↑
(5)SO 在沉淀乙中加稀盐酸,若白色沉淀能完全溶解,则X中不存在SO;若不能完全溶解,则存在SO
15.(2009·济宁质量检测)某一无色溶液,可能含有Na+、Cu2+、NH、Fe3+、Al3+、Mg2+、CO、SO、K+等离子中的一种或几种,为确定其组成,做如下实验:
①取少量待测溶液,向其中滴入盐酸酸化的氯化钡溶液,生成白色沉淀;
②另取少量待测溶液,向其中加入过氧化钠,产生无色无味气体,并生成白色沉淀;加入过量过氧化钠时,沉淀部分溶解。
试判断:溶液中一定存在的离子有________;一定不存在的离子有________。不确定的是________,为验证此离子的存在,还应进行________实验。
答案:Al3+、Mg2+、SO NH、Cu2+、Fe3+、CO K+、Na+ 焰色反应
14.(2009·江苏)下列化学实验事实及其解释都正确的是 ( )
A.向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘
B.向SO2水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸
C.向0.1 mol·L-1 FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性
D.向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1滴-2滴0.01 mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
解析:B项中HCl酸性强于H2SO3,且BaSO3可溶于盐酸,故SO2不可能与BaCl2溶液反应;C项中KMnO4溶液褪色是因为被Fe2+还原,Fe2+具有还原性。
答案:AD
13.(2009·四川)下列有关物质检验的实验结论正确的是 ( )
|
选项 |
实验操作及现象 |
实验结论 |
|
A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO |
|
B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
|
C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
|
D |
将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成 |
该物质一定属于醛类 |
解析:A中无法排除Ag+为干扰;C使品红褪色的物质可以是SO2,还可以是其他具有漂白性的物质,如:Cl2溶于水可生成具有漂白性的HClO。D只能证明该有机物中含有醛基,但不一定是醛类,比如说甲酸、甲酸酯,甲酸盐,都能发生银镜反应。
答案:B
12.(2009·南昌一中,十中,新建二中三校联考)有一瓶无色气体,可能含有H2S、CO2、HCl、HBr、SO2中的一种或几种,将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的BaCl2溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的AgNO3溶液,也产生了白色沉淀,与此有关的下列结论中,正确的是 ( )
A.肯定有HCl、SO2[来源:]
B.可能含有HBr、CO2
C.肯定没有CO2、H2S、HBr
D.以上结论均不正确
答案:D
11.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
( )
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
溴水 |
蒸馏 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
O2 |
点燃 |
|
D |
淀粉(KCl) |
H2O |
置于半透膜 |
|
袋中漂洗 |
|
|
|
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com