
题目列表(包括答案和解析)
11.(2009年全国卷Ⅰ)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的化学式是____________;
(2)Q的具有相同化合价且可以相互转变的氧化物是-__________________ ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是____________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点
从高到低排列次序是(填化学式)____________,其原因是____________ 。
②电子总数相同的氢化物的化学式是____________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和
该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是____________ 。
10.已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。
试回答下列问题:
(1)写出四种元素的名称:
A____________,B____________,
D____________,E____________。
(2)用电子式表示离子化合物A2B的形成过程:____________ 。
(3)写出C的原子结构示意图____________ 。
(4)写出下列物质的电子式:
D元素形成的单质____________ ;
E与B形成的化合物____________ ;
A、B、E形成的化合物____________ ;
D与E形成的共价化合物____________ 。
9.据周期表知识回答下列问题:(1)PH3分子与NH3分子的构型关系____________(填“相似”或“不相似”),P-H键____________(填“有”或“无”)极性,PH3分子____________(填“是”或“不是”)极性分子。
(2)NH3与PH3相比,热稳定性____________更强。
(3)NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是( )
A.键的极性:N-H比P-H强
B.分子的极性:NH3比PH3强
C.相对分子质量:PH3比NH3大
D.NH3分子之间存在特殊的分子间作用力(氢键)
8.(2009年新疆模拟)某分子的球棍模型如右图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
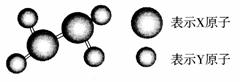
A.X原子可能为ⅤA族元素
B.Y原子一定为ⅠA族元素
C.该分子中,既含极性键,
又含氢键
D.从圆球的大小分析,该分子可能为N2F4
7.(2009年山东模拟)下列说法中,正确的是( )
A.Na2O2固体中阳离子和阴离子的个数比为2∶1
B.短周期元素X和Y的原子序数相差2,则X与Y既可能同周期,也可能同主族
C.若R2+和M-离子具有相同的电子层结构,则原子半径R<M
D.原子的L层电子数为偶数的元素均不能形成双原子分子单质
6.(2009年北京卷)甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是( )
A.某钠盐溶液含甲电离出的阴离子,
则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
5.(2009年泰安质检)下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl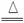 NH3↑+HCl↑
NH3↑+HCl↑
B.NH3+CO2+H2O=NH4HCO3
C.2NaOH+Cl2=NaCl+NaClO+H2O
D.2Na2O2+2CO2=2Na2CO3+O2
4.(2009年昌乐质检)下列电子式正确的是( )
A.

B.
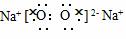
C.
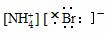
D.
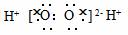
3.现有如下各说法:
①在水中氢、氧原子间均以化学键相结合;
②金属和非金属化合形成离子键;
③离子键是阳离子、阴离子的相互吸引;
④根据电离方程式HCl=H++Cl-,可判断HCl分子里存在离子键;
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程。
上述各种说法正确的是( )
A.①②⑤
B.都不正确
C.④
D.仅①不正确
2.(2009年韶关质检)下列各分子中,所有原子都满足最外层为8电子结构的是( )
A.H2O
B.BF3
C.CCl4
D.PCl5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com