
题目列表(包括答案和解析)
4.(2009·汕头模拟)下列物质在空气中久置变质,在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是 ( )
A.食盐 B.漂白粉 C.氯水 D.生石灰
答案:B
3.在一种酸性溶液中,可能存在NO、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下的推测中不正确的是 ( )
A.一定有碘离子 B.不含铁离子
C.一定有氯离子 D.不含硝酸根离子
答案:C
2.(2009·西城模拟)物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质浓度、反应温度等有关。下列各组物质:
①Cu与HNO3溶液 ②Fe与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是 ( )
A.①② B.①③
C.③④ D.②④
解析:Cu与浓HNO3溶液反应时生成NO2,与稀HNO3溶液反应时生成NO;Fe与FeCl3溶液的反应与浓度无关;Zn与浓H2SO4溶液反应时生成SO2,与稀H2SO4溶液反应时生成H2;Fe与HCl溶液的反应与浓度无关。
答案:B
1.下列说法中正确的是 ( )
A.强氧化剂和弱还原剂易发生氧化还原反应
B.实验室制氯气的反应中,氯离子通过还原反应生成氯气
C.由HgCl2生成Hg2Cl2时,汞元素被还原了
D.I-、Br-、Cl-的还原性依次减弱,氧化性依次增强
答案:C
19.(2009·辽宁)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略)。
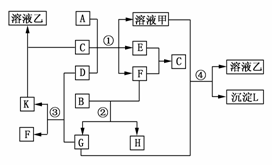
(1)A、B、C、D代表的物质分别为________、________、________、________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是___________________________
________________________________________________________________________;
(3)反应②中,若B与F物质的量之比为4?3,G、H分别是________、________(填化学式);
(4)反应③产物中K的化学式为_____________________________________________;
(5)反应④的离子方程式为________________________________________________。
解析:据题干信息和框图知:B为碳,C为H2O,D为Na2O2(因E+F―→H2O),A为Al(能与NaOH溶液反应的金属),而碳与O2可生成CO2(G)和CO(H),其他可依次推出:K为Na2CO3粉末、甲为NaAlO2、乙为Na2CO3、L为Al(OH)3。
答案:(1)Al C H2O Na2O2
(2)2Na2O2+2H2O===4NaOH+O2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(3)CO2 CO (4)Na2CO3
(5)CO2+AlO+OH-+H2O===CO+Al(OH)3↓
6.30 g 1.12 L
解得x?y=2?3,即n(K)?n(O)=2?3,
即A中两种化合物为KO2和K2O2,其物质的量之比为2?1,
或A中两种化合物为KO2和K2O,其物质的量之比为4?1。
18.(2009·东北三校)钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3===6K2O+N2↑),39.0 g钾与10.1 g硝酸钾充分反应生成K2O的质量为________g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为28%,则样品中K2O2的质量分数为________。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2===2K2CO3+3O2),KO2在医院、矿井、潜水、高空飞行中用做供氧剂。13.2 L(标准状况)CO2和KO2反应后,气体体积变为18.8 L(标准状况),计算反应消耗的KO2的质量。
(4)KO2加热至600℃部分分解得到产物A。6.30 g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12 L(标准状况),试确定产物A中钾、氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
解析:(1)39.0 g钾与10.1 g硝酸钾的物质的量分别为1 mol和0.1 mol,故在反应10K+2KNO3===6K2O+N2↑中KNO3不足,K2O的质量为0.3 mol×94 g·mol-1=28.2 g。
(2)K2O2的质量分数为×100%=96.25%。
(3)由4KO2+2CO2===2K2CO3+3O2知KO2的消耗量是反应前后气体增加量的4倍。所以m(KO2)=n(KO2)×M(KO2)=4×()×71 g·mol-1=71 g。
答案:(1)28.2 (2)96.25% (3)71 g。
(4)KxOy+CO2===K2CO3+O2
(39x+16y)g 11.2(y-0.5x)L
17.工业纯碱中常含有NaCl、Na2SO4等杂质,为了测定工业纯碱中Na2CO3的含量,某同学设计了如下图装置:

试回答下列问题:
(1)装置A中发生反应的化学方程式为:_______________________________________
__________________________________________。
(2)装置D的作用是____________________________________________________
___________________。
(3)利用上述装置进行实验,即使气密性良好,并缓慢滴加了过量的稀硫酸使反应完全,装置C中装有足量碱石灰,其他操作也正确,测定结果还是偏低,原因可能是:________________________________________________________________________
________________________________________________________________________。
你的改进措施是(用文字叙述或在题图中添加所需装置)__________ ______________
________________________________________________________________________。
(4)实验前所取工业纯碱质量为m g,装置C中碱石灰和U形管的总质量为m1 g,加入足量稀硫酸,反应结束后,装置C中碱石灰和U形管的总质量变为m2 g,则上述实验中测得的工业纯碱中Na2CO3的质量分数为__________________________________________。
(5)利用上图A、B装置(B中仍用浓硫酸做干燥剂),还可以制取哪些气体?______________________________(填三种气体的化学式)。
答案:(1)Na2CO3+H2SO4===Na2SO4+CO2↑+H2O
(2)防止空气中的CO2和水蒸气进入C装置
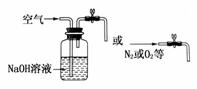
(3)反应生成的部分CO2残留在装置A、B及导管内
向装置内通入除去了CO2的空气(或氮气等)或在装置图左边连接下列装置
(4)×100%
(5)H2、O2、SO2、NO2、Cl2等(任选三种)
16.某溶液中可能含有Na+、K+、SO、CO等离子中的全部或几种。为确定其成分,现进行以下的连续操作:
①用洁净的铂丝蘸取无色溶液在无色的火焰上灼烧,火焰呈黄色;
②向溶液中加入足量的稀H2SO4,无气体放出;
③再加入Ba(NO3)2溶液,有白色沉淀生成。
试填写下列空白:
(1)原溶液中一定存在的离子是__________________,一定不存在的离子是__________________。
(2)上述操作中________是错误的,应改为加入__________以便确定________是否存在。
(3)为了确定________是否存在,再补充的操作是________________________________________________________________________
________________________________________________________________________。
答案:(1)Na+ CO (2)② 盐酸 SO (3)K+ 用洁净的铂丝蘸取溶液在酒精灯上灼烧,透过蓝色钴玻璃观察火焰颜色
15.(2009·南京)某溶液中含有HCO、SO、AlO、CO四种离子,若向其中加入Na2O2后,溶液中离子浓度基本保持不变的是 ( )
A.HCO B.SO
C.AlO D.CO
解析:Na2O2投入溶液中后首先考虑与水反应,生成大量NaOH,则OH-增多,而HCO与OH-能反应生成CO和H2O,因此HCO减少,CO增多,注意的是SO被Na2O2氧化为SO而减少,故选C项。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com