
题目列表(包括答案和解析)
18.(2009·全国卷Ⅰ)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
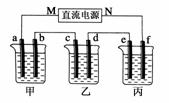
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为__________极;
②电极b上发生的电极反应为__________________;
③列式计算电极b上生成的气体在标准状况下的体积:__________________________________________;
④电极c的质量变化是__________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因是:
甲溶液:__________________________________________________________________;
乙溶液:__________________________________________________________________;
丙溶液:__________________________________________________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
________________________________________________________________________
解析:(1)据装置图可知:此图为串联电路,在甲、丙中实质为电解水,乙中电解CuSO4溶液(2CuSO4+2H2O2Cu+O2↑+2H2SO4),因乙中c电极质量增加(有Cu析出),则c为阴极,d为阳极。丙中e为阴极,f为阳极,电源N端为正极;由于b为阳极,其电极反应为4OH--4e-===2H2O+O2↑。在丙中,由于水的电解使K2SO4的浓度由10%→10.47%,设电解的水质量(减少的水)为x,则有100g×10.00%=(100g-x)×10.47%,解出x=100g-95.5g=4.5g,甲、乙电解的水质量相等,2H2O2H2↑+O2↑
2 mol 22.4 L
V(O2)
V(O2)=2.8 L。
电极c上反应为Cu2++2e-===Cu,质量变化为×4××64 g·mol-1=16 g。在电解前后,甲溶液因NaOH溶液浓度增大,碱性增强;
(2)乙中铜全部析出后,溶液为稀H2SO4,可继续电解。
答案:(1)①正 ②4OH-4e-===2H2O+O2↑ ③水减少的质量:100g×(1-)=4.5g,
生成O2的体积:××22.4 L·mol-1=2.8 L
④16 ⑤碱性增强,因为电解后,水量减少溶液中NaOH浓度增大酸性增强,因为阳极上OH-生成O2,溶液中H+离子浓度增加 酸碱性强弱没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应。
17.甲、乙两池电极材料都是铁棒与碳棒(如图)。请回答下列问题:
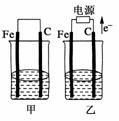
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的__________棒;乙池中的__________棒。
②在乙池中阳极的电极反应式是____________________________________。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式__________________。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5?1,且生成两种酸。该反应的化学方程式为__________________。
解析:甲为原电池,乙为电解池。
(1)两池均盛放CuSO4溶液时,甲中Fe为负极,Fe-2e-===Fe2+,C为正极,Cu2++2e-===Cu,故C棒上会析出红色物质铜。乙中由电子流向可知,Fe为阴极,其电极反应式:Cu2++2e-===Cu,C为阳极其电极反应式:4OH--4e-===2H2O+O2↑。即在铁棒上会析出红色物质铜。
(2)若两池中均盛放饱和NaCl溶液,则
①乙池中发生总反应的离子方程式为:2Cl-+2H2OH2↑+Cl2↑+2OH-。
②由Cl2和I2反应的物质的量之比为5?1,故I被氧化为+5价的酸,应为HIO3。所以该反应的化学方程式为5Cl2+I2+6H2O===10HCl+2HIO3。
答案:(1)①C Fe
②4OH--4e-===2H2O+O2↑
(2)①2Cl-+2H2OH2↑+Cl2↑+2OH-
②5Cl2+I2+6H2O===10HCl+2HIO3
16.(2009·安庆模拟)如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是 ( )
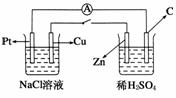
A.Cu极附近OH-浓度增大
B.Cu极为原电池负极
C.电子流向是由C极流向Pt极
D.当C极上有4 mol电子转移时,Pt极上有1 mol O2生成
解析:从反应的自发性程度判断左池为电解池,右池为原电池,Zn为负极,C为正极,Pt为阳极,Cu为阴极。Cu极上反应式:2H++2e-===H2↑,使OH-浓度增大,故A项正确,B项不正确;电子从Pt流向C,故C项不正确;Pt有4 mol电子转移时生成2 mol Cl2,故D项不正确。
答案:A
15.(2009·山东省英雄山中学高三第一学期期末考试)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。则以下说法不正确的是 ( )
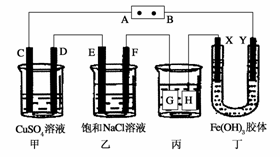
A.电源B极是负极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1?2?2?2
C.欲用丙装置给铜镀银,H应是Ag,电镀渡是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
[答案] C
14.(2008·上海化学)取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圆为白色,外圈呈浅红色。则下列说法错误的是 ( )
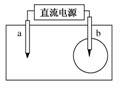
A.b电极是阴极
B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
解析:根据题意,a电极产生Cl2,为阳极,与电源正极相连,则b为阴极。D项中b电极上H+放电,附近OH-浓度增大,pH变大。
答案:D
13.(2009·北京)下列叙述不正确的是 ( )
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-===4OH-
D.工业上电解饱和食盐水的阳极反应:2Cl--2e-===Cl2↑
解析:电镀时镀件作阴极,镀层金属作阳极。
答案:A
12.(2009·广东)钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O===2Fe(OH)2;
②4Fe(OH)2+O2+2H2O===4Fe(OH)3;
③2Fe(OH)3===Fe2O3+3H2O。
下列说法正确的是 ( )
A.反应①②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
解析:反应①②中均为O2→,故转移电子数相等。C、D中因形成原电池而易发生电化学腐蚀。
答案:A
11.(2009·山东省枣庄市高三第一学期期末检测)下列关于实验现象的描述不正确的是
( )
A.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铁片表面出现气泡,铜片表面无气泡
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
D.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
答案:BD
10.(2009·长春模拟)已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。关于标有“+”的接线柱,下列说法中正确的是 ( )
A.充电时作阳极,放电时作正极
B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极
D.充电时作阴极,放电时作正极
[答案] A
9.(2009·湖北师大一附中期中)有两只串联的电解池,甲池盛有CuSO4溶液,乙池盛有某硝酸盐溶液,用惰性电极电解,当甲池的阴极上析出1.6 g Cu时,乙池的阴极上析出0.6 g固体,则乙池的溶质可能是 ( )
A.NH4NO3 B.Al(NO3)3
C.Cu(NO3)2 D.Mg(NO3)2
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com