
题目列表(包括答案和解析)
15.(2009年高考台湾卷)下表所列为五种可溶性盐在30 ℃的溶解度(g/100 g H2O):
|
盐 |
NaCl |
NaHCO3 |
Na2CO3 |
(NH4)2CO3 |
NH4Cl |
|
溶解度 |
36.5 |
12.1 |
30.0 |
27.0 |
41.1 |
若在30 ℃的饱和食盐水中通入氨气至饱和后,再通入二氧化碳就会有晶体析出。试参考表中的数据,推测析出的晶体是下列的哪一种( )
A.NaCl B.NaHCO3
C.Na2CO3 D.(NH4)2CO3
E.NH4Cl
解析:选B。食盐水中通入氨气,再通入CO2后,溶液中应含Na+、Cl-、NH4+、CO32-、HCO3-。各盐类的溶解度大小为:NH4Cl>NaCl>Na2CO3>(NH4)2CO3>NaHCO3,其中Na+、HCO3-会先形成NaHCO3结晶析出。
14.(2009年高考海南卷)在5 mL 0.05 mol/L的某金属氯化物溶液中,滴加0.1 mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( )
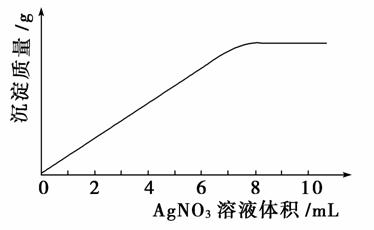
A.+1 B.+2
C.+3 D.+4
解析:选C。从图中可以看出,AgNO3溶液的体积应在7-8 mL之间。由于5 mL金属氯化物的溶液中所含Cl-的物质的量与Ag+的物质的量相等,设金属氯化物的化学式为MClx,粗略计算有:5.0 mL×0.05 mol·L-1×x=8.0 mL×0.1 mol·L-1,解得x=3.2。所以,认定金属元素的化合价为+3。
13.向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为( )
A.0.24 mol B.0.21 mol
C.0.16 mol D.0.14 mol
解析:选B。混合物完全溶解且向所得溶液中加入KSCN溶液,无血红色出现,则铁元素完全转化为Fe(NO3)2,由N元素守恒可得,原混合物中铁的总物质的量为:(0.12 L×4 mol·L-1-1.344 L÷22.4 L·mol-1)=0.21 mol。再由铁元素守恒可知还原相同质量的混合物所得铁的物质的量也是0.21 mol,故选B。
12.下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:
2Al+2OH-===2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:
Al3++3OH-===Al(OH)3↓
C.三氯化铁溶液中加入铁粉:Fe3++Fe===2Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2===2Fe3++2Cl-
解析:选D。离子反应方程式必须符合反应原理,A应为2Al+2H2O+2OH-===2AlO2-+3H2↑;氨水是弱碱不能写成离子形式,B错;离子方程式必须符合质量(原子个数)守恒和电荷守恒,所以C错。
11.下列叙述正确的是( )
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
解析:选C。选项A中稀硫酸不能氧化木炭。选项B中红热的Fe与水蒸气反应的产物是Fe3O4和H2,无碱生成。选项C中生成的氧化物分别是Li2O、CO2和P2O5,正确。选项D中Na2CO3受热不分解,无气体生成。
10.硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。下列说法中不正确的是( )
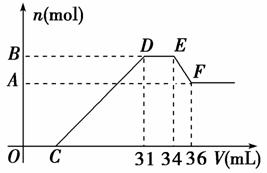
A.合金与硝酸反应时硝酸过量
B.合金中铝的物质的量为0.008 mol
C.合金中金属的物质的量共为0.032 mol
D.无法求出C点的值
解析:选D。由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故合金的氧化产物为Fe(NO3)3、Al(NO3)3。图中:(1)O→C:H++OH-===H2O;(2)C→31:R3++3OH-===R(OH)3↓(R代表Fe或Al);(3)31→34:NH4++OH-===NH3·H2O;(4)34→36:Al(OH)3+OH-===AlO2-+2H2O。由(4)知n[Al(OH)3]=0.002 L×4 mol/L=0.008 mol=n(Al)。由(3)知,n(NH4NO3)=0.003 L×4 mol/L=0.012 mol,根据反应中得失电子相等的原则得:3n(R3+)=0.012×8=0.096 mol,则n(R3+)=0.032 mol=n(合金)。O→31 mL中,用于沉淀金属离子的OH-有0.096 mol,故C点:(0.031 L×4 mol/L-0.096 mol)/4 mol·L-1=0.007 L,即7 mL。因此本题应选D。
9.从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉淀、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
解析:选B。本题考查从海水中提取镁的过程。原料是海水和贝壳,来源丰富,A选项正确;涉及的化学反应有Ca(OH)2+MgCl2===Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl===MgCl2+2H2O,MgCl2+6H2O===MgCl2·6H2O,MgCl2·6H2OHCl△MgCl2+6H2O↑,MgCl2(熔融)Mg+Cl2↑,在第④步电解时,阴极产生的是金属镁,B选项错误;从上面的分析可知C和D选项正确。
8.向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必须提供下列哪项数据( )
A.M(OH)2溶液的物质的量浓度
B.与MCO3反应的盐酸的物质的量浓度
C.MCO3的质量
D.题给条件充足,不需要再补充数据
解析:选C。M(OH)2+2NaHCO3===MCO3↓+Na2CO3+2H2O,MCO3+2HCl===MCl2+H2O+CO2↑,收集到的V L(标准状况下)气体为CO2,据此可以确定MCO3的物质的量,如果再知道MCO3的质量,则可确定MCO3的摩尔质量,进一步可求出金属M的相对原子质量。
7.下列有关铁及其化合物的说法中不正确的是( )
A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C.工业上可用铁质容器储存、运输浓硝酸和浓硫酸
D.氯化铁溶液有较强氧化性,故可用作净水剂
解析:选D。FeCl3作净水剂是利用Fe3+水解生成Fe(OH)3胶体的吸附作用,而不是氧化性。
6.向含1 mol HCl和1 mol MgSO4的混合溶液中加入1 mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( )
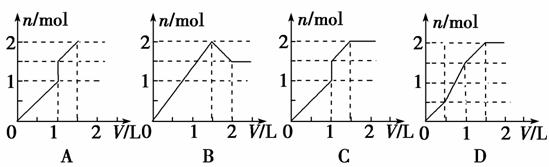
解析:选D。起始:Ba2++SO42-===BaSO4↓,由于HCl的存在,只能生成BaSO4沉淀。随着Ba(OH)2的加入,中和了溶液中的H+后,开始出现Mg(OH)2沉淀;当Ba(OH)2加至1 L时,SO42-完全沉淀,但此时Mg2+仍有剩余,持续加入Ba(OH)2至1.5 L时,Mg2+也完全沉淀。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com