
题目列表(包括答案和解析)
21.(12分)有一无色透明溶液,欲确定是否含有以下十种离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行以下实验:
①取少量待测液加几滴石蕊溶液,溶液显红色。
②取少量溶液,浓缩后加Cu和浓硫酸,加热,有无色气体产生,此无色气体遇空气变成红棕色。
③取少量溶液,加过量氯化钡溶液,有白色沉淀产生。
④取实验③中上层清液滴加AgNO3溶液,有白色沉淀产生,此沉淀不溶于硝酸。
⑤另取少量原溶液滴加NaOH溶液,有白色沉淀产生,当NaOH过量时,部分沉淀溶解。
根据以上实验,溶液中肯定存在的离子:_____________________;
肯定不存在的离子:_____________________________________;
尚不能确定的离子是:___________________________________。
解析:既然是溶液,则Ba2+与SO42-不能同时存在。据实验①可判断HCO3-肯定不存在(H++HCO3-===CO2↑+H2O),NO3-与Fe2+、I-不能同时存在(6I-+2NO3-+8H+===3I2+2NO↑+4H2O,3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O);根据实验②可判断NO3-一定存在,则Fe3+、I-不存在;根据实验③,SO42-肯定存在,则Ba2+不存在;根据实验④,不能肯定原溶液中有无Cl-存在,因为实验③加入了BaCl2,只能是可能存在;由实验⑤可判断Mg2+、Al3+都存在,剩下的Na+只是可能存在。
答案:Mg2+、Al3+、NO3-、SO42- Ba2+、Fe2+、HCO3-、I- Na+、Cl-
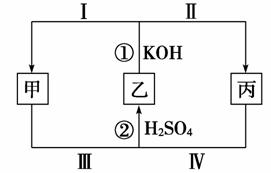
20.(16分)化学中有一种在同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,甲、乙、丙三种物质中含有同一种元素。
(1)若乙为Cl2,丙为KClO,则:
①甲的化学式为________。
②反应②的化学方程式为________________________,该反应中被氧化与被还原的氯元素质量之比为________。
③若将反应①设计成原电池,正极反应过程为________(用“Ⅰ”或“Ⅱ”填空)。
(2)若甲、乙、丙中所含相同元素X的化合价分别为a、b、c,且a<b<c,反应①进行过程中其他元素化合价不变,则该反应中氧化产物与还原产物中X元素的物质的量之比为________(用a、b、c表示)。
解析:(1)由常见的化合价变化,乙为Cl2,丙为KClO,则甲为KCl。
反应① 2KOH+Cl2===KCl+KClO+H2O
反应② KCl+KClO+H2SO4===K2SO4+Cl2↑+H2O
若将①设计成原电池,正极为还原过程为Ⅰ。
(2)反应①中氧化产物为丙,还原产物为甲,设甲、丙中X的物质的量为x、y,则由氧化还原反应规律知:
(b-a)×x=(c-b)×y
解得y∶x=
答案:(1)①KCl
②KCl+KClO+H2SO4===K2SO4+Cl2↑+H2O 1∶1 ③Ⅰ
(2)(b-a)∶(c-b)
19.(12分)电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:
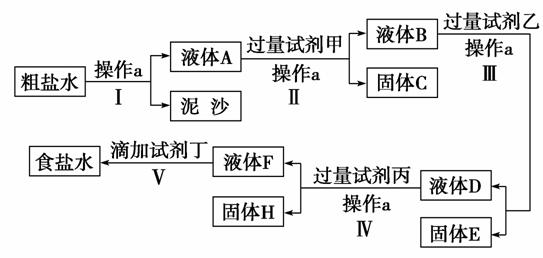
(1)操作a的名称是________,所用玻璃仪器有________。
(2)在第Ⅱ步中,加入过量试剂甲后,生成了两种大量沉淀,则试剂甲为(填化学式)________溶液。
(3)在第Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式________________________________
___________________________________________________________。
解析:除去泥沙的操作是过滤,加入试剂甲后生成了两种沉淀,则甲为NaOH溶液,生成的两种大量沉淀是Mg(OH)2和Fe(OH)3;第Ⅲ步加入的物质为BaCl2溶液,第Ⅳ步加入的物质为Na2CO3溶液(注意:Na2CO3溶液须在BaCl2溶液后,以除去过量的BaCl2),试剂丁为盐酸以除去过量的NaOH、Na2CO3。
答案:(1)过滤 玻璃棒、漏斗、烧杯 (2)NaOH(合理即可)
 (3)H++OH-===H2O、H++CO32-===HCO3-、HCO3-+H+===H2O+CO2↑
(3)H++OH-===H2O、H++CO32-===HCO3-、HCO3-+H+===H2O+CO2↑
18.(6分)已知4种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、Na+、NH4+、CO32-、NO3-、OH-、SO42-。将这4种溶液分别标记为A、B、C、D并进行如下实验:
①在A或D中滴入C,均有沉淀生成;
②A和B反应生成的气体能被D吸收;
③A和D反应生成的气体能被B吸收。
试回答下列问题:
(1)A的化学式是________,判断的理由是___________________
_______________________________________________________。
(2)写出其他几种物质的化学式:B_________、C_________、D________。
(3)写出实验③中有关反应的离子方程式____________________________________________________________
______________________________________________________。
解析:8种离子中能与其他离子反应并生成气体的只有NH4+和CO32-,从而确定了A,离子之间反应能产生沉淀的只有Ba2+和SO42-或CO32-,CO32-存在于A中,则SO42-存在于D中,D与A反应能生成气体,则D中有H+,则C为Ba(NO3)2,B是NaOH,A是(NH4)2CO3,D是H2SO4。
答案:(1)(NH4)2CO3 8种离子中能与其他离子反应并生成气体的离子只有NH4+和CO32-,所以A是(NH4)2CO3
(2)NaOH Ba(NO3)2 H2SO4
(3)CO32-+2H+===CO2↑+H2O,
CO2+2OH-===CO32-+H2O(或CO2+OH-===HCO3-)
17.(6分)对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
(1)现有下列6种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2。按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法):
①_____________________________________________________;
②_____________________________________________________。
(2)从上述物质中分别找出两种能相互反应的物质,各写一个非氧化还原反应的方程式和氧化还原反应的方程式:________________、
、________________。
(3)虽然分类的方法不同,但离子反应和氧化还原反应之间也存在着一定的关系,请用简单的图示方法表示二者之间的关系:___________________________________________________________。
(4)生活中的食醋和淀粉分属于分散系中的__________和________,用________可以鉴别(填化学专用名词)。
解析:(1)找不同类的物质,关键抓住其余5种物质的共同点,可以从物理性质和化学性质两方面分析。(2)根据常见物质的转化关系分析。(3)氧化还原反应与离子反应不存在包含关系,但二者有交集。(4)食醋属于溶液,淀粉属于胶体,可用丁达尔效应鉴别。
答案:(1)①SO2常温常压下是气体,其余是固体
②Na2O2是过氧化物,其余为酸性氧化物或碱性氧化物
(2)CaO+SiO2CaSiO3(或MgO+SO2MgSO3等其他合理答案) Na2O2+SO2===Na2SO4
(3)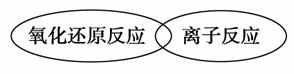 (意思正确、能表示二者的交叉关系即可)
(意思正确、能表示二者的交叉关系即可)
(4)溶液 胶体 丁达尔效应
16.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A.K+一定存在
B.100 mL溶液中含0.01 mol CO32-
C.Cl-可能存在
D.Ba2+一定不存在,Mg2+可能存在
解析:选AC。本题考查的是离子的检验。由步骤(1)可知,Cl-、CO32-、SO42-三者中至少有一种;由步骤(2)可知,一定有NH4+且可算出有NH4+0.04 mol,由步骤(3)可知,同时有CO32-、SO42-且可算出SO42-有0.01 mol,有CO32-0.02 mol,考虑到离子共存问题,可知原溶液中无Mg2+、Ba2+,考虑到电荷守恒,可知阳离子除了NH4+外必定还有K+。故答案为AC。
15.在复杂的体系中,确认化学反应先后顺序有利于解决问题。下列化学反应先后顺序判断正确的是( )
A.在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
B.在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中缓慢通入CO2:KOH、Ba(OH)2、BaCO3
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+
解析:选D。A项,根据AlO2-+HCO3-+H2O===Al(OH)3↓+CO32-知,相同浓度OH-、AlO2-、CO32-的碱性OH->AlO2->CO32-,加入盐酸反应的顺序为OH-、AlO2-、CO32-,故A错;B项,三种离子的还原性强弱顺序为:I->Fe2+>Br-,故B错;C项,Ba(OH)2先反应,因为K2CO3与Ba(OH)2不能共存,故C错。D项,氧化性顺序:Ag+ >Cu2+>H+>Fe2+,正确。
14.下列A-D 4组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是( )
|
|
Ⅰ |
Ⅱ |
|
A |
少量SO2通入Ba(OH)2溶液中 |
过量SO2通入少量Ba(OH)2溶液中 |
|
B |
少量浓氨水滴入Al2(SO4)3溶液中 |
少量Al2(SO4)3溶液滴入浓氨水中 |
|
C |
0.1 mol Cl2通入含0.2 mol FeBr2的溶液中 |
0.3 mol Cl2通入含0.2 mol FeBr2的溶液中 |
|
D |
过量稀硝酸与少量铁屑混合 |
少量稀硝酸与过量铁屑混合 |
解析:选B。A项SO2少量生成正盐,过量生成酸式盐;B项均生成Al(OH)3;C项Ⅰ中反应为2Fe2++Cl2===2Fe3++2Cl-,Ⅱ中为2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-;D项铁屑少量生成Fe3+,铁屑过量生成Fe2+。
13.下列各组离子在指定溶液中不能共存的是( )
①无色溶液中:K+、Ca2+、Cl-、Na+、SO42- ②使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32- ③水电离的c(H+)=10-13 mol·L-1的溶液中:ClO-、HCO3-、NO3-、NH4+、S2O32- ④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- ⑤使甲基橙变红的溶液中:MnO4-、NO3-、SO42-、Na+、SO32- ⑥pH=1的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2-
A.②③④ B.①⑤⑥
C.①②⑤ D.①③⑥
解析:选BD。①中CaSO4为微溶物,③中在酸性条件下ClO-、HCO3-、S2O32-不存在,碱性条件下HCO3-不存在,⑤中酸性条件下SO32-被MnO4-、NO3-氧化,⑥中HNO3会氧化Fe2+、I -、S2-。
12.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个反应:SO2+2Fe3++2H2O===SO42-+2Fe2++4H+,Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O,有关说法正确的是( )
A.还原性:Cr3+>Fe2+>SO2
B.氧化性:Cr2O72->SO2>Fe3+
C.Cr2O72-能将Na2SO3氧化成Na2SO4
D.两个反应中Fe2(SO4)3均作还原剂
解析:选C。第一个反应中,Fe3+能将SO2氧化,故其氧化性比SO2强,B错;第一个反应中,还原性:SO2>Fe2+,第二个反应中,还原性:Fe2+>Cr3+,故还原性顺序为:SO2>Fe2+>Cr3+,由第二个反应知Fe2(SO4)3为氧化产物,不可能成为还原剂,所以A、D错;Cr2O72-的氧化性强于Fe3+,而Fe3+又能将SO2氧化,故Cr2O72-能将Na2SO3氧化成Na2SO4,C正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com