
题目列表(包括答案和解析)
494.下列叙述正确的是 ( )
⑴元素的单质可由氧化或还原含该元素的化合物来制得
⑵ 得电子越多的氧化剂,其氧化性就越强
⑶阳离子只能得到电子被还原,只能作氧化剂
⑷含有最高价元素的化合物不一定具有强的氧化性
⑸有单质参加的反应一定是氧化还原反应
⑹银镜反应中醛基具有氧化性
⑺非金属性弱的单质不能制得非金属性强的单质
⑻化合物与水的反应,水不可能做氧化剂
A.⑴⑵⑷⑹ B.⑴⑷⑸⑺ .⑶⑸⑹⑻ D。⑴⑷
493.由稀有气体元素Xe(氙)形成的一种化合物Xe3 极不稳定,易转化为单质而呈强氧化性。将适量的Xe3 投入30mL0.1ml·L-1 Mn2+的水溶液中,刚好完全反应,放出唯一气体是Xe单质,其在标准状况下的体积为6mL 。则:
(1)有关反应现象是________________________________________
(2)若Xe3 是分子晶体,试写出有关的化学方程式:________________________
(3)若将原溶液稀释至90mL ,则稀释后溶液的PH值为___________
492.实验室为监测空气中汞蒸气的含量;往往悬挂涂有I的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4I+Hg→2HgI4+2
(1)上述反应产物2HgI4中,元素显 价。
(2)以上反应中的氧化剂为 ,当有1mlI参与反应时,转移电子 ml。
(3)I可由2+与I-直接反应制得,请配平下列反应的离子方程式。
2++ I-→ I+ I3-
491.已知r结构式如右图。现在稀H24酸化的H22溶液中,加入乙醚后液体分层,再加入少量的2r27溶液并振荡,在乙醚层中出现深蓝色。其主要反应的离子方程式为:r272-+4H22+H+= 2r+H2,下列叙述中正确的是( )
A.r272-被氧化成 r B.该反应属于氧化还原反应
.反应中H22被氧化成H2 D.此反应可用于检验r272-的存在
490.在一定条件下,氯酸钾与碘发往反应l3+I2=2I3+l2。下列相应的结论中,不正确的是( )
A.该反应属置换反应 B.还原性:I2>l2
.非金属性:I2>l2 D.氧化性:l3>I2
489.制备氰氨基化钙的化学方程式 a3 + 2HN = aN2 + + H2 + 2 在反应中 ( )。
A.氢元素被氧化,碳元素被还原 B.HN既是氧化剂,又是还原剂
.aN2是氧化产物,H2是还原产物 D.为氧化产物,H2为还原产物
488. 将l和rl3两种固体混合物共熔制得化合物X,X由、l、r元素组成。将1.892gX中r元素全部氧化成r272-, r272-可过量的I中氧化出2.667g I2,反应的离子方程式是:r272-+6I-+14H+=2r3++3 I2+7H2,如果取溶有1.892g X的溶液,加入过量的AgN3,可得4.2gAgl沉淀,则表示X组成的化学式为( )
A.3r2l7 B.3r2l .3r2l9 D.2rl4
487.已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200mL混合溶液中含FeI2、FeBr2各0.10ml,向其中逐滴滴入氯水(假定l2分子只与溶质离子反应,不考虑其它反应)
(1)若氯水中有0.1 ml l2被还原,则所得溶液中含有的阴离子主要是 ,剩余Fe2+的物质的量为 。
(2)若原溶液中Br-有一半被氧化,共消耗l2的物质的量为 ,若最终所得溶液为400mL,其中主要阳离子及其物质的量浓度为 。
(3)通过对上述反应的分析,试判断l2、I2 、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是
。
、Fe3+、Br2四种氧化剂的氧化能力由强到弱的顺序是
。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被l2氧化成HI3(强酸)。试写出此反应的离子方程式 ,
上述所有反应共消耗l2 ml。
486..G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的分子式(或化学式),但知道它们在一定条件下具有以下的转换关系(未配平)
(1) G ® Q+Nal
(2) Q+H2 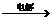 X+H2
X+H2
(3) Y+NaH ® G+Q+H2 (4) Z+NaH ® Q+X+H2
这五种化合物中氯的化合价由低到高的顺序为( )
A. QGZYX B. GYQZX . GYZQX D. ZXGYQ
48.下列说法正确的是( )
A.阳离子只有氧化性,阴离子只有还原性
B.金属单质在化学 反应中只作还原剂,非金属单质只作氧化剂
反应中只作还原剂,非金属单质只作氧化剂
.氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
D.有单质参加的反应不一定是氧化还原反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com