
题目列表(包括答案和解析)
7.将0.03mol Cl2缓缓通入含0.02mol H2SO3和0.02molHBr的溶液中,在此过程中,溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变) ( )

6.与铁相似,金属锡能溶于盐酸生成氯化亚锡,氯化亚锡又能被氯化铁氧化为氯化锡。则下列有关离子的氧化、还原能力的比较中,正确的是 ( )
A.氧化能力:Sn4+<Sn2+ B.氧化能力:Fe3+<Sn4+
C.还原能力:Fe2+<Sn2+ D.还原能力:Fe<Sn
5.下列同组中的两个不同反应(在溶液中进行),可用同一离子方程式表示的是 ( )
A.Na2CO3+HNO3与NaHCO3+HNO3 B.CaCl2+Na2CO3与Ca(NO3)2+K2CO3
C.Ba(OH)2+NaHSO4与BaCl2+NaHSO4 D.NaOH+H2SO4与Fe(OH)3+H2SO4
4.在上世纪末期,科学家发现并证明碳有新的单质形态C60存在。后来人们又相继得到了C70、C76、C84、C90、C94 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是 ( )
A.熔点比较:C60 <C70 <C90 <金刚石
B.已知C(石墨,s) C(金刚石,s);△H >0,则石墨比金刚石稳定
C(金刚石,s);△H >0,则石墨比金刚石稳定
C.C70、C76、C84、C90、C94它们都是C60的同素异构形体
D.金刚石与C60、C70、管状碳和洋葱状碳都不能与H2发生加成反应
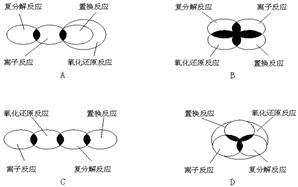
3.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,其正确的是
( )
2.通常人们把拆开lmol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
A-A |
B-B |
A-B |
|
生成1mol化学键时放出的能量 |
436kJ·mol-1 |
243 kJ·mol-1 |
431 kJ·mol-1 |
则下列热化学方程式不正确的是 ( )
A.1/2A2 (g)+1/2B2 (g)=AB(g) △H=-91.5 kJ·mol-1
B.A2 (g)+ B2(g) =2AB(g) △H=-183 kJ·mol-1
C.1/2A2 (g)+1/2B2 =AB(g) △H=+91.5 kJ·mol-1
D.2A B(g)= A2 (g)+ B2 (g) △H=+183 kJ·mol-1
1.(2010·山东)下列与化学反应能量变化相关的叙述正确的是 ( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用热化学方程有关计算规律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的△H不同
23.(9分)(2007海南·14)依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。
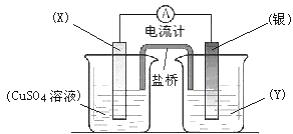
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极(填电极材料名称,下同)流向 电极。
22.(6分)从H+、Na+、Cu2+、Cl-、SO42-五种离子中组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水量不变进行电解,则可采用的电解质是 ;
(2)以铂片为电极,使电解质质量不变,水量减少进行电解,则可采用的电解质是_ _;
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量都减少,进行电解,则可采用的电解质是______。
21.(15分)(1)下面是用98%的浓度H2SO4(ρ=1.84/cm3)配制成0.5 mol/L的稀H2SO4500mL的操作,请按要求填空:
①所需浓H2SO4的体积为 。
②如果实验室有15mL、20mL、50 mL量筒,应选用 mL量筒最好。
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 mL水的烧杯里,并不断搅拦,目的是 。
④将冷却至室温的上述溶液沿 注入 中,并用50 mL蒸馏水洗涤2-3次,洗涤液要一并注入上述容器中,并摇匀。
⑤加水至距刻度1-2㎝时,改用 加水,使溶液的凹液面正好跟刻度相平。
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“不变”)
①定容时观察液面俯视 ;
②NaOH颗粒表面部分变质 ;
③用胶头滴管向容量瓶中加水时凹面高于刻度线,此时立即用胶头滴管将瓶内液体吸出,使凹液面与刻度线相切 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com