
题目列表(包括答案和解析)
6.某恒温恒容的容器中,建立如下平衡:2A(g) B(g),在相同条件下,若分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时 ( )
B(g),在相同条件下,若分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时 ( )
A.都增大 B.都减小
C.前者增大,后者减小 D.前者减小,后者增大
5.恒温下,aX(g)  bY(g) + cZ(g)反应达到平衡,把容器体积压缩到原来的1/2,达到新平衡时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是 ( )
bY(g) + cZ(g)反应达到平衡,把容器体积压缩到原来的1/2,达到新平衡时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是 ( )
A.混合气的密度减小 B.容器中压强增大为原来的二倍
C.容器中混合气相对分子质量减小 D.a>b+c
4.已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是 ( )
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是 ( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
3.反应:CO(g)+H2O(g) CO2(g)+H2(g)在某固定容积的容器中达平衡后,其它条件不变,增大CO的浓度,下列说法不正确的是 ( )
CO2(g)+H2(g)在某固定容积的容器中达平衡后,其它条件不变,增大CO的浓度,下列说法不正确的是 ( )
A.正反应速率先增大后减小 B.达新平衡时,正反应速率比原平衡要大
C.逆反应速率先减小后增大 D.达新平衡时,逆反应速率比原平衡要大
2.在下列平衡体系中,保持温度一定时,若改变某物质的浓度,混合气体的颜色会改变;若改变压强,颜色也会改变,但平衡并不移动,这个反应是 ( )
A.2NO+O2 2NO2 B.N2O4
2NO2 B.N2O4  2NO2
2NO2
C.Br2(g)+H2  2HBr D.6NO+4NH3
2HBr D.6NO+4NH3  5N2+3H2O
5N2+3H2O
1.有平衡体系:CO(g) + 2H2(g)  CH3OH(g);△H<0。为了增加CH3OH(甲醇)的产量,工厂应采取正确的措施是 ( )
CH3OH(g);△H<0。为了增加CH3OH(甲醇)的产量,工厂应采取正确的措施是 ( )
A.高温、高压 B.适宜的温度、高压、催化剂
C.低温、低压 D.低温、低压、催化剂
21.(9分)工业上制备单质碘的方法之一是从碘酸盐开始的。第一步先用适量的亚硫酸氢盐将碘酸盐还原成碘化物,离子方程式为:IO3-+3HSO3- = I-+3SO42-+3H+。第二步将第一步得到的酸性碘化物溶液再跟适量的碘酸盐溶液混合,发生反应析出了碘。试问:
(1)第二步发生反应的离子方程式是:__________________________。
(2)若要使碘酸盐的利用率最高,碘酸盐在第一步和第二步反应中的用量之比为_____。
(3)①配平下列离子方程式:
Fe(OH)3+ ClO-+ OH--- FeO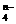 + Cl-+ H2O
+ Cl-+ H2O
②已知有3.21 g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=__________,FeO4n-中铁的化合价为_____________。
20.(8分)⑴偏二甲肼(C2H8N2)是发射航天飞机常用的高能燃料。一般将它与液态N2O4作为火箭的推进剂。它们反应的产物是氮气、二氧化碳和水蒸气。写出该反应的化学反应方程式_______________________________________,在发射过程中会看到大量红色的烟雾,除了该反应可能产生少量NO外,产生此现象的原因可能是
。
⑵在汽车的油气比(汽油与空气的体积比)_______________(填偏大或偏小)时,尾气中含有的大气污染物NOx含量会增多,有人提出用NH3在催化剂存在下除去NOx,其反应方程式为:____________________________ _________________。
⑶在飞船的表面通常覆盖有一种耐高温的氮化硅陶瓷,该物质中各原子均满足8电子结构,则氮化硅晶体类型是_________________。
⑷锂钒氧化物电池的能量密度大,成本低,污染小。电池总反应式为:V2O5+xLi=LixV2O5。电池工作时锂离子向正极迁移,固体介质不参加电池反应。该电池负极反应式为______________________________________。
19.(8分)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。下图为N2(g)和O2(g)生成NO(g)过程中的能量变化
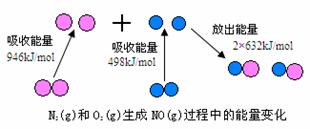
(1)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,则N≡N的键能为___________ kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学反应方程式_______________________
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①根据下列反应的热化学反应式,计算由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H。
C(石墨) + O2(g) = CO2(g);△H1 = - 393.5 kJ/mol
2H2(g) + O2(g) = 2H2O(l);△H2 = - 571.6 kJ/mol
2C2H2(g) + 5 O2(g) = 4CO2(g) + 2H2O(l);△H3 = - 2599.2 kJ/mol,则由C(石墨)和H2(g)反应生成1mol C2H2(g)的△H _______________________ kJ/mol。
②已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1mol C与O2反应生成CO的反应热△H为_________
18.(10分)能源是人类社会发展进步的物质基础,能源、信息、材料一起构成了现代文明的三大支柱。为了缓解能源危机和减少汽油燃烧所产生的污染,目前已普遍推广使用新型车用燃料--乙醇汽油。乙醇汽油是将乙醇和普通汽油按一定体积比混合而成的,已知某乙醇汽油蒸气中乙醇和汽油的体积比约为1:4。请回答下列问题:
(1)若以辛烷代表汽油的成分,请写出乙醇汽油完全燃烧的化学方程式:
。
(2)若以辛烷代表汽油的成分,并设空气中氧气所占的体积分数为1/5,则相同条件下,相同体积汽油、乙醇汽油分别在气缸内完全燃烧时,所消耗空气的体积比是 。
(3)若用乙醇汽油设计燃料电池,在一个电极通入空气,另一个电极通入乙醇汽油蒸气,电解质是是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子,则该电池正极发生的电极反应式是 。
(4)据最新报道,巴西新一代乙醇燃料汽车总量已经突破200万辆,为了更好推广乙醇燃料汽车的使用,巴西政府决定向普通汽车购买者征收16%的消费税,而只向乙醇燃料汽车 购买者征收14%的消费税。巴西地处南美洲,是世界上甘蔗产量巨大的国家之一,乙醇是通过甘蔗渣制备加工出来的。请写出相应的化学反应方程式:
。
(5)请列举推广使用乙醇汽油的优点(至少回答两点)
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com