
题目列表(包括答案和解析)
1.将作物秸秆、垃圾、粪便等“废物”在隔绝空气的条件下发酵,会产生大量的可燃性气体。这项措施既减少了“废物”对环境的污染,又开发了一种能作生活燃料的能源。这种可燃性气体的主要成分是 ( )
A.CH4 B.CO2
C.CO D.H2
[答案] A
18.镁是一种轻金属,其合金的强度高、机械性能好。这些特性使金属镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。海水矿物质中镁的浓度仅次于氯和钠,居第三位。由于对镁的需求非常巨大,很多沿海国家都建有大型海水提镁工厂。下表是有关物质的Ksp:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
|
溶度积 |
2.8×10-9 |
6.8×10-6 |
5.5×10-6 |
1.8×10-11 |
回答下列问题:
(1)能否直接把贝壳研磨成粉末,撒入海水中使Mg2+转化为MgCO3沉淀,其原因是________________________________________________;
(2)实际生产中是把Mg2+转化为Mg(OH)2沉淀,而不是转化为MgCO3沉淀,其理由是__________________,请你推测应将贝壳进行怎样的加工处理______________________________________;
(3)某同学在实验室条件下模拟该生产过程,在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他__________(填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是_______________________________。
(4)过滤出Mg(OH)2沉淀后,用试剂__________(填化学式)将其溶解,选择该试剂的理由是______________________________________________________________________。
解析:(1)CaCO3和MgCO3化学式所表示的组成中阴、阳离子个数比相同,从Ksp看,CaCO3的溶解能力比MgCO3的小,所以不能直接加贝壳粉末使Mg2+转化为MgCO3沉淀;
(2)MgCO3的溶度积比Mg(OH)2的溶度积大,所以应把Mg2+转化为Mg(OH)2沉淀,即把贝壳研磨、煅烧、加水制成石灰乳[Ca(OH)2];
(3)根据沉淀的转化,烧碱电离产生的OH-能结合MgCO3溶解产生的Mg2+生成溶解度更小的Mg(OH)2沉淀,使MgCO3的溶解平衡不断向右移动;
(4)盐酸电离的H+与Mg(OH)2溶解产生的OH-生成水,使Mg(OH)2的溶解平衡不断右移;
答案:(1)不能,MgCO3的溶解度比CaCO3溶解度大,直接加贝壳粉末得不到MgCO3沉淀
(2)为使Mg2+沉淀完全,应将Mg2+转化为溶解度更小的Mg(OH)2 研磨、煅烧、加水制成石灰乳
(3)能 烧碱电离产生的OH-能结合MgCO3溶解产生的Mg2+生成溶解度更小的Mg(OH)2沉淀,使MgCO3的溶解平衡不断向右移动
(4)HCl 盐酸电离的H+与Mg(OH)2溶解产生的OH-生成水,使Mg(OH)2的溶解平衡不断右移
17.某自来水中含有Ca2+、Mg2+、Na+、K+、HCO、SO、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
|
物质 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
CaSO4 |
MgSO4 |
|
溶解度 |
|
|
|
|
|
|
|
(g/100 g H2O) |
9.0×10-4 |
1.5×10-3 |
1.0×10-2 |
1.7×10-1 |
2.1×10-1 |
26.7 |
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:__________________。
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是__________(填序号)。
A.食醋 B.氯化钡
C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)______________________________
_________________________________________________________________。
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)__________________。
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应。现取含Ca2+浓度为0.40 g/L的自来水样10 mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00 mL,则该自来水样中Mg2+的物质的量浓度是__________________。
答案:(1)Mg(HCO3)2MgCO3↓+H2O+CO2↑
MgCO3+H2OMg(OH)2+CO2↑
(2)C 碳酸钙的溶解度小于硫酸钙的溶解度
(3)CaCO3、MgCO3等
(4)0.01 mol/L
16.(2009·山东)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡__________(填“向左”“向右”或“不”)移动;使用催化剂__________(填“增大”“减小”或“不改变”)反应的ΔH。
(2)已知:O2(g)===O(g)+e-;ΔH1=1175.7 kJ·mol-1
PtF6(g)+e-===PtF(g);ΔH2=-771.1 kJ·mol-1
OPtF(s)===O(g)+PtF(g);ΔH3=482.2 kJ·mol-1
则反应O2(g)+PtF6(g)===OPtF(s)的ΔH=__________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为__________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-),则溶液显__________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=__________。
解析:(1)恒压时通入氩气使容器体积增大(相当于减压),平衡向左移动,催化剂对反应热无影响。
(2)据盖斯定律:将(1)+(2)-(3)得O2(g)+PtF6(g)===OPtF(s);ΔH=-77.6 kJ·mol-1。
(3)因Ksp[Mg(OH)2]>Ksp[Cu(OH)2],先生成Cu(OH2)沉淀。
(4)据电荷守恒c(NH)+c(H+)=c(Cl-)+c(OH-),则c(H+)=c(OH-)=1×10-7mol·L-1,
由NH3·H2ONH+OH-
(a-0.01)mol·L-1 0.01 mol·L-1 1×10-7 mol·L-1
Kb==mol·L-1。
答案:(1)向左 不改变 (2)-77.6 (3)Cu(OH)2 Cu2++2NH3·H2O===Cu(OH)2↓+2NH (4)中 mol·L-1
1.(2)减小 (3)0×10-6mol·L-1
(4)①能,Ksp(AgY)=1.0×10-12>Ksp(AgZ)=8.7×10-17
②能,当溶液中c(X-)>1.8×10-4mol·L-1时,AgY开始向AgX转化
15.(2009·山东青岛)已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。
AgX(s)Ag+(aq)+X-(aq)
Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s)Ag+(aq)+Y-(aq)
Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s)Ag+(aq)+Z-(aq)
Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/溶液的体积表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为__________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)__________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为__________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:______________________。
②在上述(3)体系中,能否实现AgY向AgX的转化?根据自己的观点选答一项。
若不能,请简述理由:_________________________________________________
________________________________________________________________________。
若能,则实现转化的必要条件是:__________________。
答案:(1)S(AgX)>S(AgY)>S(AgZ)
14.(2009·皖西四校模拟)分析、归纳、探究是学习化学的重要方法和手段之一。下面就电解质A性质回答有关问题(假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol·L-1的A溶液的pH=a。
①试说明HnB的酸性强弱__________________。
②当a=10时,A溶液呈碱性的原因是(用离子方程式表示)__________________。
③当a=10、n=1时,A溶液中各种离子浓度由大到小的顺序为__________________。c(OH-)-c(HB)=__________。
④当n=1、c=0.1、溶液中c(HB)?c(B-)=1?99时,A溶液的pH为__________(保留整数值)。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρg·cm-3,Xm+离子的浓度为c mol·L-1,则该难溶物XnYm的溶度积常数为Ksp=__________________,该温度下XnYm的溶解度S=__________。
解析:(1)①若a=7,说明NanB为强酸强碱盐,HnB为强酸;若a>7,说明盐NanB发生水解,则HnB为弱酸。
②当a=10时,HnB为弱酸,Bn-将发生水解,即Bn-+H2OHB(n-1)-+OH-。
③当a=10,n=1时,NaB溶液中存在以下平衡:B-+H2OHB+OH-,H2OH++OH-,而B-的水解较微弱,其离子浓度大小关系为:c(Na+)>c(B-)>c(OH-)>c(H+),溶液中OH-一部分来自水解,一部分来自水的电离,即c(OH-)=c(OH-)水解+c(OH-)水=c(HB)+c(H+),故c(OH-)-c(HB)=c(H+)=10-10mol/L。
④可设溶液B-水解x mol/L,则有=1?99,得x=0.001 mol/L,故c(OH-)=0.001(mol/L),溶液中c(H+)==1×10-11(mol/L),pH=11。
(2)由XnYmnXm++mYn-可知当c(Xm+)=c mol/L时,c(Yn-)=c mol/L,则Ksp=cn(Xm+)·cm(Yn-)=c·()m=()m·cm+n。
设XnYm溶液体积为1 L,则溶解XnYm mol达到饱和,由=,得S=。
答案:(1)①当a=7时HnB为强酸,当a>7时HnB为弱酸
②Bn-+H2OHB(n-1)-+OH-
③c(Na+)>c(B-)>c(OH-)>c(H+) 10-10mol·L-1
④11
(2)()m·cm+n
13.(2009·汕头模拟)已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO+H2O===Cu(OH)2↓+CO2↑
次要:Cu2++CO===CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-===CuS↓
次要:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是 ( )
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
解析:由(1)知溶解度Cu(OH)2<CuCO3,由(2)知溶解度CuS<Cu(OH)2。
答案:A
12.(2009·山东聊城高三期末)Cu(OH)2在水中存在着沉淀溶解平衡:Cu(OH)2(s)Cu2+(aq)+2OH-(aq),在常温下Ksp=2×10-20。某CuSO4溶液中c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液的pH,则溶液的pH大于
( )
A.2 B.3 C.4 D.5
答案:D
11.(2009·广东)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是
( )
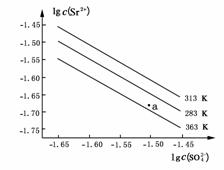
A.温度一定时,Ksp(SrSO4)随c(SO)的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
解析:因Ksp(SrSO4)=c(Sr2+)·c(SO),分析曲线知,温度越高,Ksp(SrSO4)越大,即SrSO4溶解度越大,温度相同时Ksp(SrSO4)为定值。
答案:B、D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com