
题目列表(包括答案和解析)
0.3 mol 0.1 mol
根据:===35.6 g/mol。
(2)3O22O3 ΔV
3体积 2体积 1体积
V(L) 8-6.5=1.5 L
V=3 L
(3)加热条件下,O3、O2都能和铜粉反应,故粉末增加的质量即为O2和O3的总质量。
设混合气体中含有O2 x mol,含有O3 y mol
则有
解之可得,
所以混合气体中臭氧的体积分数为50%。
[答案] (1)35.6 (2)3 (3)0.5
23.(6分)(2009·上海单科)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O22O3
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为________g/mol(保留一位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________L。
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为________。
[解析] (1)设有1 mol O2,则有
3O22O3 Δn
3 mol 2 mol 1 mol
22.(10分)已知:A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志。根据下面转化关系回答问题。
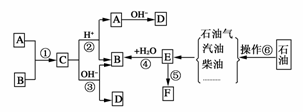
(1)操作⑥的名称为_________________________________________________________。
(2)取代反应的范畴很广,①-⑤中属于取代反应的是________(填序号)。
(3)请写出下列反应的化学方程式:
①________________________________________________________________________;
③________________________________________________________________________;
⑤________________________________________________________________________。
(4)F是一种常见的高分子材料,它给我们带来了巨大的方便。然而,这种材料造成的当今的某一环境问题是________________________________________________________。
[解析] 根据“E是石油化工发展水平的标志”可知E为乙烯。一方面,乙烯可以转化成F,另一方面,乙烯与水反应生成B。结合“B、F都是家庭中常见的物质”的信息,推断B是乙醇,F是聚乙烯。观察框图,C在酸性或碱性条件下都可以得到乙醇,说明C是某种酸与乙醇反应生成的酯。既然这种酸是家庭中常见的物质,则A是醋酸。其他答案可依次推出。
[答案] (1)分馏 (2)①②③
(3)①CH3CH2OH+CH3COOH浓硫酸△CH3COOCH2CH3+H2O
③CH3COOCH2CH3+NaOHCH3COONa+CH3CH2OH
(或其他合理写法)
⑤nCH2=CH2?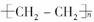 ?
?
(4)白色污染
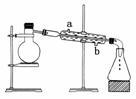
21.(10分)从煤中可以得到苯及苯的同系物,苯及苯的同系物是重要的有机化工原料。
(1)从煤中得到煤焦油的方法为________;
(2)用下面装置从煤焦油中分离出苯及苯的同系物,还需要的仪器为________,冷凝管进水口为________(填“a”或“b”);
(3)用甲苯可以制造一种烈性炸药TNT,反应如下:
 3H2O,其反应类型为________;
3H2O,其反应类型为________;
(4)用苯和丙烯可以生产两种重要的有机化工原料:苯酚和丙酮。生产流程如下:
,①A
已知反应①是加成反应,A的一氯代物有5种,则A结构简式为________________________;反应②的化学方程式为___________________________。
[答案] (1)干馏 (2)酒精灯、温度计 b
(3)取代反应
20.(12分)(思维拓展题)某化学研究性学习小组在实验室中模拟海水提取溴的过程,其实验流程如下:
海水除去悬浮杂质氧化剂氧化Br2(g)Na2CO3溶液吸收[NaBrNaBrO3]Br2
(1)取24 L除去悬浮杂质后的海水,浓缩至2 L;
(2)向其中通入足量Cl2,反应的离子方程式:__________________________,通入热空气的目的:______________________________________;
(3)将吹出的Br2用纯碱溶液吸收,反应得到NaBr、NaBrO3和CO2,反应的化学方程式:____________________________,产生的CO2通入足量澄清石灰水中,得到1 g白色沉淀;
(4)将吸收Br2的溶液用足量硫酸处理得到Br2单质,反应的化学方程式:____________________________,理论上可以得到Br2的质量为__________________;
(5)请计算海水中溴的浓度为________g/L。
[解析] 通过反应Cl2+2Br-===Br2+2Cl-置换出溴单质后,一般用热空气或水蒸气将Br2吹出;根据各步反应,可确定如下关系:Br2-CO2-CaCO3,根据CaCO3的质量可求出原24 L海水中Br2的质量为=1.6 g,则海水中溴的浓度为=0.067 g/L。
[答案] (2)Cl2+2Br-===Br2+2Cl-
将Br2吹出
(3)3Br2+3Na2CO3===5NaBr+NaBrO3+3CO2↑
(4)5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O 1.6 g
(5)0.067
19.(8分)金属热还原法广泛用于冶金过程中。用金属A(或其合金)作还原剂在高温下将另一种金属B的化合物还原以制取金属B(或其合金)的方法,通常是按还原剂来命名。
(1)用铝作还原剂产生金属铬,称为铝热法,化学方程式为_____________________。
(2)用硅作还原剂还原V2O3冶炼钒,称为硅热法,化学方程式为________________________________________________________________________。
硅(特别是硅铁)的价格比铝低,所以硅热还原法在铁合金及某些金属的生产中占有重要地位。但硅的还原能力不如铝,为使硅热还原更易进行,常加入CaO作熔剂。试分析加入CaO的作用:_______________________________________________。
(3)试写出用镁热还原TiCl4生产金属钛的化学方程式:
________________________________________________________。
[答案] (1)2Al+Cr2O32Cr+Al2O
(2)2V2O3+3Si3SiO2+4V
加入CaO与生成的SiO2反应,CaO+SiO2CaSiO3,使反应更易进行
(3)TiCl4+2MgTi+2MgCl2
18.(2009·上海市南汇区高三第一学期期末考试)研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO
②SO3+H2O→H2SO4
③2NO+O2→2NO2
NO2在上述过程中的作用与H2SO4在下列变化中的作用相似的是 ( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.SO3被浓H2SO4吸收
C.少量胆矾放入浓硫酸中
D.加入少量H2SO4使乙酸乙酯水解
答案:D
第Ⅱ卷(非选择题,共46分)
17.(2009·江苏单科)《中华人民共和国食品安全法》于2009年6月1日起实施。下列做法不利于食品安全的是 ( )
A.用聚氯乙烯塑料袋包装食品
B.在食用盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
[答案] A
16.(2009·浙江理综)下列说法正确的是 ( )
A.蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物
B.氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用
C.使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用
D.石油、煤、天然气、可燃冰、植物油都属于化石燃料
[答案] B
15.(2009·上海单科)下列措施不能达到节能减排目的的是 ( )
A.利用太阳能制氢燃料
B.用家用汽车代替公交车
C.利用潮汐能发电
D.用节能灯代替白炽灯
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com