
题目列表(包括答案和解析)
12.(2009·天津)已知:(1)2CO(g)+O2(g)===2CO2(g);ΔH=-566kJ/mol
(2)Na2O2(s)+CO2(g)===Na2CO3(s)+O2(g);ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是 ( )
A.CO的燃烧热为283kJ
B.图可表示由CO生成CO2的反应过程和能量关系
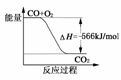
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
解析:A中单位错,应为kJ·mol-1;B中始态应为2CO+O2,终态为CO2;C中因CO2(s)===CO2(g);ΔH>0,故该反应的放热减少,ΔH增大;D项,由得CO(g)+Na2O2(g)===Na2CO3(s);ΔH=kJ·mol-1=-509kJ·mol-1,即放热509kJ时有1 mol CO参加反应,转移电子数为2NA。
答案:C
11.(2009·重庆)下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-1367.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);ΔH=+57.3kJ/mol(中和热)
C.S(s)+O2(g)SO2(g);ΔH=-296.8kJ/mol(反应热)
D.2NO2===O2+2NO;ΔH=+116.2kg/mol(反应热)
解析:A项:燃烧热强调生成稳定的氧化物,其中水应为H2O(l);B项:中和热为放热,ΔH为“-”;D项:未注明反应物,生成物的状态。
答案:C
10.(2008·海南化学)白磷与氧可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、P-O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1
根据下图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是 ( )
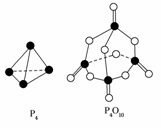
A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4c+5d-4c-12b)kJ·mol-1
解析:化学键断裂吸收的能量为(6a+5d)kJ,化学键生成放出的能量为(12b+4c)kJ。
答案:A
9.(2008·天津滨海新区5月)2008年北京奥运会“祥云”火炬用的是环保型燃料-丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为2221.5 kJ·mol-1,下列有关说法正确的中 ( )
A.奥运火炬燃烧主要是将化学能量转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(g);ΔH=-2221.5 kJ·mol-1
解析:根据能量守恒定律得出A项正确;B项,丙烷的相对分子质量小于正丁烷的相对分子质量,应是正丁烷的沸点高;C项,燃料电池中通入可燃性气体的一极应为负极;所谓燃烧热是指1 mol可燃烧气体完全燃烧生成稳定的氧化物所放出的热量,而D项中的H2O是气态,不是稳定氧化物。
答案:A
8.(2008·广东东莞5月)中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是 ( )
A.用NaOH和HCl反应测得的中和热,推算一定量稀H2SO4和NaOH溶液的反应热
B.用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性
C.用沸点数据分析分子的稳定性
D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱
解析:分子的稳定性与分子内部共价键有关系,而沸点数据只与分子间作用力有关系,不能用沸点数据来分析分子的稳定性。
答案:C
7.(2008·广东广州4月)已知:(1)Zn(s)+1/2O2(g)===ZnO(s);ΔH=-348.3 kJ·mol-1
(2)2Ag(s)+1/2O2(g)===Ag2O(s);ΔH=-31.0 kJ·mol-1
则Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)的ΔH等于 ( )
A.-317.3 kJ·mol-1 B.-379.3 kJ·mol-1
C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
解析:根据盖斯定律,将反应(1)-(2)得到相应的反应,ΔH=-348.3 kJ·mol-1-(-31.0 kJ·mol-1)=-317.3 kJ·mol-1
答案:A
6.阿伏加德罗常数为NA,则关于C2H2(g)+O2(g)===2CO2(g)+H2O(l);ΔH=-1300 kJ·mol-1的下列说法中,正确的是 ( )
A.有10 NA个电子转移时,吸收1300 kJ的能量
B.有2 NA个CO2(气态)和NA个H2O(液态)生成时,放出1300 kJ的能量
C.有NA个水分子生成且为液体时,吸收1300 kJ的能量
D.有2NA个C2H2反应且为气态时,放出1300 kJ的能量
[答案] B
5.分析下图所示各物质能量变化关系,下列热化学方程式正确的是 ( )

A.C(金刚石)+O2(g)===CO2(g);ΔH1=a kJ·mol-1(a<0)
B.C(石墨)+O2(g)===CO2(g);ΔH2=b kJ·mol-1(b>0)
C.C+O2===CO2(g);ΔH=c kJ·mol-1(c>0)
D.C(金刚石)===C(石墨);ΔH4=d kJ·mol-1(d>0)
[答案] A
4.100 g碳粉燃烧所得气体中,CO占,CO2占体积,且C(s)+CO2(g)===CO(g);ΔH=-110.35 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-282.57 kJ·mol-1
与这些碳完全燃烧相比较,损失的热量是 ( )
A.392.92 kJ B.2489.44 kJ
C.784.92 kJ D.3274.3 kJ
[答案] C
3.(2009·山东省枣庄市高三第一学期期末检测)根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);
ΔH=-Q1kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(l);
ΔH=-Q2kJ·mol-1
2H2S(g)+O2(g)=2S(s)+2H2O(g);
ΔH=-Q3kJ·mol-1
对Q1、Q2、Q3三者大小关系的判断正确的是 ( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2
C.Q3>Q2>Q1 D.Q2>Q1>Q3
[答案] A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com