
题目列表(包括答案和解析)
2.(2009·潍坊模拟)在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
不能确定上述可逆反应在一定条件下已达到化学平衡状态的是 ( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H-H键断裂的同时断裂2 mol H-O键
答案:C
1.对于可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
解析:由题意知v正(O2)?v(逆)(NO)=5?4,达到平衡时,v正(NO)=v逆(NO),故A正确;生成NO和消耗NH3,都表示正反应速率,B错;扩大容器体积,各物质的浓度都减小,所以正、逆反应速率都减小,C错;在反应的任意状态总有v正(NH3)?v正(H2O)=4?6,即3v正(NH3)=2v正(H2O),D不正确。
答案:A
21.(2009·皖南八校联考)向一体积不变的密闭容器中充入2 mol A,0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)3C(g),各物质的浓度随时间变化的关系如图1所示,其中t0-t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件。
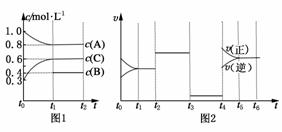
(1)若t1=15 min,则t0-t1阶段以C的浓度变化表示的反应速率v(C)=__________。
(2)t3时改变的条件为__________________,
B的起始物质的量为__________________
(3)t4-t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式:__________________。
解析:(1)由图1可知,在t0-t1阶段C的浓度变化为0.3 mol/L-0.6 mol/L,则v(C)==0.02 mol/(L·min)。
(2)由该反应方程式2A(g)+B(g)3C(g)可知减小压强或取出部分平衡混合气,可同等程度地减小正、逆反应速率。在t0-t1阶段,c(A)减少了0.2 mol/L,则c (B)减少0.1 mol/L,故B的起始浓度为0.4 mol/L+0.1 mol/L=0.5 mol/L,物质的量为0.5 mol/L×2 L=1.0 mol。
(3)由题意知t4-t5阶段A的物质的量减少0.01 mol,吸收a kJ能量,则2 mol A参加反应,应吸收能量×2=200a kJ,故其热化学方程式为2A(g)+B(g)3C(g) ΔH=+200a kJ/mol。
答案:(1)0.02 mol/(L·min) (2)减小压强或取出部分平衡混合气体;1.0mol (3)2A(g)+B(g)3C(g); ΔH=+200a kJ/mol
20.加入0.1 mol MnO2粉末于50 mL过氧化氢(H2O2,ρ=1.1 g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示。
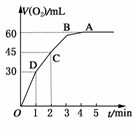
(1)实验时放出气体的总体积是__________。
(2)放出一半气体所需时间为__________。
(3)反应放出气体所需时间为__________。
(4)A、B、C、D各点反应速率快慢的顺序为__________。
(5)解释反应速率变化的原因___________________________________________。
(6)计算H2O2的初始物质的量的浓度。
(7)求反应到2 min时,H2O2的质量分数。
解析:根据V-t图像知,反应进行到1 min时,放出O2的体积为30 mL,反应进行至2 min时,放出O2 45 mL,反应进行至4 min时,放出O2的体积达最大值60 mL;由V-t曲线的斜率变化可知:D、C、B、A的反应速率逐渐减小,这是因为随着反应的进行,c(H2O2)逐渐减不,反应速率逐渐变慢;
根据2H2O22H2O+O2↑,
n(H2O2)=×2,
所以H2O2的起始物质的量浓度为
=0.107 mol·L-1;
反应进行至2 min时,消耗H2O2的物质的量为
n′(H2O2)=×2=0.004 mol,
剩余H2O2的物质的量为
×2-×2=1.34×10-3mol。
所以w(H2O2)=
×100%=0.083%。
答案:(1)60 mL (2)1 min (3)2 min (4)D>C>B>A (5)随着反应的进行,c(H2O2)逐渐减小,反应速率逐渐变慢 (6)0.107 mol·L-1。(7)0.084%。
19.(2009·青岛)“碘钟”实验中,3I-+S2O===I+2SO的反应速率可以用I与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/(mol·L-1) |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(S2O)/(mol·L-1) |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是_____________________________________________________。
(2)显色时间t1=________________________________________________________。
(3)温度对该反应的反应速度的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为__________(填字母)。
A.<22.0 s B.22.0 s-44.0 s
C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________。
解析:本题主要考查外部因素如浓度、温度对化学反应速率的影响。由已知数据可知,当c(I-)和c(S2O)乘积相等时,显色时间相等,即反应速率相等,但时间与速度成反比,故
t1==29.3 s。升高温度加快化学反应速率,即缩短显蓝色的时间,故t<22.0 s。
答案:(1)研究反应物I-与S2O的浓度对反应速率的影响 (2)29.3 s (3)A (4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
18.(2009·宁夏)硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3+H2SO4===Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
( )
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c(mol·L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
解析:D与A、B比较,D温度高;D与C比较,溶液混合后体积相同,而D中n(Na2S2O3)比C中大。
答案:D
17.(2009·广东)已知汽车尾气无害化处理反应为2NO(g)+2CO(g)
 N2(g)+2CO2(g)。下列说法不正确的是 ( )
N2(g)+2CO2(g)。下列说法不正确的是 ( )
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
解析:升高温度、正逆反应速率都会增大。
答案:A
16.在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1-t4(s)时刻测得各物质的浓度如下表。据此下列结论正确的是 ( )
|
测定时刻/s |
t1 |
t2 |
t3 |
t4 |
|
c(A)/mol·L-1 |
6 |
3 |
2 |
2 |
|
c(B)/mol·L-1 |
5 |
3.5 |
3 |
3 |
|
c(C)/mol·L-1 |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B===C
D.在t2-t3内A的平均反应速率为[1/(t3-t2)]mol/(L·s)
答案:D
15.(2009·山大附中模拟)如图曲线a表示放热反应X(g)+Y(g)
 Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是 ( )
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是 ( )
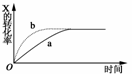
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
解析:由题给图示可知,由a曲线到b曲线,X的转化率不变,但到达平衡的时间缩短了,即改变条件对平衡没有影响,又因该反应为前后气体体积相等的可逆反应。故使用催化剂符合题意。
答案:C
14.(2008·广东理基)对于反应2SO2(g)+O2(g)
 2SO3(g),能增大正反应速率的措施是 ( )
2SO3(g),能增大正反应速率的措施是 ( )
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
解析:对于该可逆反应欲增大正反应速率可采取的措施是:①升高温度;②增大压强;③使用催化剂;④通入反应物(容器体积不变),选项中B为减压,D为降温,C为移出生成物,都是减小正反应速率。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com