
题目列表(包括答案和解析)
8.可以证明可逆反应N2+3H2
 2NH3已达到平衡状态的是:①一个N-N键断裂的同时,有3个H-H键断裂;②一个N-N键断裂的同时,有6个N-H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。 ( )
2NH3已达到平衡状态的是:①一个N-N键断裂的同时,有3个H-H键断裂;②一个N-N键断裂的同时,有6个N-H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。 ( )
A.全部 B.①③④⑤
C.②③④⑤⑦ D.①③⑤⑥⑦
答案:C
7.(2009·江西省南昌二中高三第四次阶段考试)向甲乙两个容积均为1L的恒容容器中,分别充入2mol A、4molB和1molA、2molB。相同条件下,发生下列反应:A(g)+2B(g)
 xC(g) ΔH<0。测得两容器c(A)随时间t的变化如图所示,下列说法正确的是 ( )
xC(g) ΔH<0。测得两容器c(A)随时间t的变化如图所示,下列说法正确的是 ( )


A.x可能等于3
B.向平衡后的乙容器中充入氦气可使A的转化率降低
C.将乙容器单独升温,c(A)可达到0.78mol/L
D.若向甲容器中再充入2molA、4molB,平衡时甲容器中cA大于1.56mol/L
答案:C
6.(2009·广东汕头模拟)可逆反应mA(g)+nB(g)
 pC(g)+gD(g)的v-t图像如图Ⅱ所示。
pC(g)+gD(g)的v-t图像如图Ⅱ所示。

①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图Ⅱ中阴影部分面积更大
以上正确的为 ( )
A.②④⑤⑦ B.②④⑥⑧
C.②③⑤⑦ D.③④⑥⑧
答案:C
5.(2009·山东省烟台市高三模块检测)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的判断结论正确的是
( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的判断结论正确的是
( )
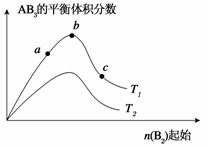
A.反应速率a>b>c
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应是放热反应
D.达到平衡时,AB3的物质的量大小为:c>b>a
答案:D
4.(2009·山东省枣庄市高三第一学期期末考试)在恒容密闭容器中A(g)+3B(g) 2C(g);ΔH<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是 ( )
2C(g);ΔH<0达平衡后,将气体混合物的温度降低,下列叙述中正确的是 ( )
A.容器中混合气体的平均相对分子质量减小
B.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.正反应速率和逆反应速率都变小,C的百分含量增加
D.混合气体密度的变化情况,可以作为判断反应是否再次达平衡的依据
答案:C
3.在一定条件下,有可逆反应N2+3H2 2NH3;ΔH<0。当单独改变下列条件后,有关叙述中错误的是 ( )
2NH3;ΔH<0。当单独改变下列条件后,有关叙述中错误的是 ( )
A.加入氩气,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
B.加入催化剂,v正、v逆都发生变化,且变化的倍数相同
C.增大压强时,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
D.降低温度时,v正、v逆都减小,且v正减小倍数小于v逆减小倍数
答案:A
2.(2008·山东济南)下列关于化学反应限度的说法中正确的是 ( )
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
解析:A项,外界条件改变时,可能会改变反应的限度。C项,如反应H2(g)+I2(g) 2HI(g),在恒容条件下,压强一直不变,因此压强不变不能作为达到反应限度的标志。D项,反应达到限度时,反应物和生成物的浓度不再变化,并不一定相等。
2HI(g),在恒容条件下,压强一直不变,因此压强不变不能作为达到反应限度的标志。D项,反应达到限度时,反应物和生成物的浓度不再变化,并不一定相等。
答案:B
1.下列关于化学反应速率的说法正确的是 ( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加
B.化学反应速率0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
答案:C
22.25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH一样的定义来规定其酸碱度:pD=-lgc(D+)。(lg4=0.6)
(1)写出重水的电离方程式。
(2)求25℃时,重水中各离子的物质的量浓度。
(3)求25℃时,重水的pD。
解析:(1)重水跟普通水的化学性质一样,都存在着电离平衡,电离方程式为D2OD++OD-
(2)已知: c(D+)·c(OD-)=1.6×10-15
所以重水中:c(D+)=c(OD-)=4×10-8mol/L
(3)25℃时,pD=-lgc(D+)=-lg(4×10-8)=7.4
答案:(1)D2OD++OD-
(2)c(D+)=c(OD-)=4×10-8mol/L
(3)7.4
21.(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中=__________。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积常数KW=______。该温度__________25℃。
(3)常温下,设pH=5的H2SO4的溶液中由水电离出的H+浓度为c1;pH=5的Al2(SO4)3溶液中由水电离出的H+浓度为c2,则=__________。
(4)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计)。
若所得混合溶液呈中性,则a∶b=__________。
若所得混合溶液pH=12,则a∶b=__________。
(5)在(2)所述温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=__________。
②若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=__________。
解析:(3)c1=c(OH-)=10-9mol/L,c2=c(H+)=10-5mol/L。
(4)若呈中性,则0.1 a=10-3b,a?b=1?100,若pH=12,则c(OH-)==0.01 mol/L,a?b=11?90。
(5)KW=1×10-13,①若呈中性,则10-13+a·Va=10-b·Vb,将a=12,b=2代入,得Va?Vb=1?10。
②若pH=10,则呈碱性,c(OH-)混==10-3mol·L-1,而c(OH-)混=,将a=12,b=2代入,得Va?Vb=1?9。
答案:(1)108 (2)1×10-13 高于 (3)10-4 (4)1?100 11?90 (5)①1?10 ②1?9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com