
题目列表(包括答案和解析)
3.(2008·志宏中学)可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是
( )
A.将混合气体通入盛有硫酸的洗气瓶
B.将混合气体通入盛有足量溴的四氯化碳溶液的洗气瓶
C.将混合气体通入盛有澄清石灰水的洗气瓶
D.将混合气体通入盛有氯化钠溶液的洗气瓶
解析:乙烯与硫酸、澄清石灰水、氯化钠溶液不反应。
答案:B
2.下列各组物质不属于同分异构体的是 ( )
A.2,2-二甲基丙醇和2-甲基丁醇
B.邻氯甲苯和对氯甲苯
C.2-甲基丁烷和戊烷
D.甲基丙烯酸和甲酸丙酯
答案:D
1.(2008·山东聊城)某些不合格的建筑装饰材料,会缓慢释放出浓度过高、影响健康的气体,这些气体最常见的是 ( )
A.二氧化氮 B.二氧化硫
C.一氧化碳 D.三苯等有机物蒸发和甲醛
解析:“三苯”是指“苯、甲苯、二甲苯”。“三苯”和甲醛是很好的有机溶剂,所以常作为建筑材料的胶黏剂、涂料、油漆的溶剂和稀释剂,越是不合格的装饰材料,这些有害物质越多。
答案:D
22.(10分)“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式_________________________________。
(2)在操作①中保持pH=8的目的是___________________________________________。
(3)沉淀Ⅰ的主要成分是____________________________________________________。
(4)操作③中加热、煮沸的目的是___________________________________________;
此步骤操作的理论依据是________________________________________________。
(5)操作④保持pH=2的目的是___________________________________________;
此步骤操作中所用的主要仪器是____________________________________________。
解析:(1)由题意知,“烂版液”是稀硝酸腐蚀锌板后得到的“废液”,所以“烂版液”中溶质的主要成分应为Zn(NO3)2。
(2)因为Zn(OH)2具有两性,能与强碱反应,故操作①中保持pH=8的目的是为了防止生成的Zn(OH)2沉淀被溶解。
(3)碱性条件下,Fe3+、Zn2+都会转化为氢氧化物沉淀,所以沉淀Ⅰ为Zn(OH)2和Fe(OH)3。
(4)操作③是为了分离Zn(OH)2和Fe(OH)3,不难想出加热、煮沸是为了促使Fe3+完全水解。
(5)通过“Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性”可知,Zn(NO3)2是一种强酸弱碱盐,易水解,故保持pH=2的目的是抑制Zn2+水解为Zn(OH)2。
答案:(1)Zn(NO3)2
4Zn+10HNO3===4Zn(NO3)2+N2O↑+5H2O
(2)防止生成的Zn(OH)2沉淀被溶解
(3)Zn(OH)2和Fe(OH)3
(4)促使Fe3+完全水解 温度越高,水解程度越大
(5)抑制Zn2+水解为Zn(OH)2
蒸发皿、酒精灯、铁架台、玻璃棒
21.(12分)(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO)变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小;④先逐渐减小,而后增大。4种趋势中可能的是________。
(2)pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol/L的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
A.HCl最快 B.H2SO4最快
C.CH3COOH最快 D.一样快
(3)某温度下,纯水中c(H+)=2×10-7mol/L,则此时c(OH-)=________mol/L。相同条件下,测得:①NaHCO3溶液,②CH3COONa溶液,③NaClO溶液,3种溶液的pH相同,那么,它们的物质的量浓度由小到大的顺序是
________________________________________________________________________。
(4)已知:酸性H2CO3>HClO>HCO,判断在等浓度的NaClO、NaHCO3混合液中,各种离子浓度关系正确的是________
A.c(Na+)>c(HCO)>c(H+)>c(OH-)
B.c(HCO)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO)+c(CO)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO)+c(ClO-)+c(OH-)+c(CO)
解析:(1)CO+H+===HCO,HCO+H+===H2O+CO2↑,所以c(HCO)先逐渐变大后又逐渐变小。
(2)同pH时,CH3COOH是弱酸,其物质的量浓度最大,与NaOH反应时,消耗NaOH必是最多的。由于c(H+)相等,与Zn作用时开始的瞬间速率是相等的。
(3)纯水中水电离的H+和OH-的浓度总是相等,与其他因素无关,故c(OH-)=2×10-7mol/L;因为酸性HClO<H2CO3<CH3COOH,故pH相同时,物质的量浓度应为NaClO<NaHCO3<CH3COONa。
答案:(1)③
(2)①CH3COOH ②CH3COOH ③D
(3)2×10-7 NaClO<NaHCO3<CH3COONa
(4)C
20.(12分)(2008·河南郑州)已知某溶液中只存在OH-、H+、NH、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH)>c(H+)>c(OH-)
②c(NH)>c(OH-)>c(Cl-)>c(H+)
③c(NH)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH)>c(OH-)
填写下列空白
(1)若溶液中只溶解一种溶质,则该溶质是________,上述四种离子浓度的大小顺序为(填序号)________;
(2)若四种离子的关系符合③,则溶质为________;
若四种离子的关系符合④,则溶质为________;
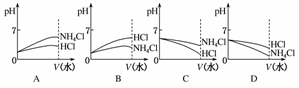
(3)则pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下列图像正确的是(填图像符号)________;
 (4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同);混合前酸中的c(H+)和碱中的c(OH-)的关系为c(H+)________c(OH-);
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”,下同);混合前酸中的c(H+)和碱中的c(OH-)的关系为c(H+)________c(OH-);
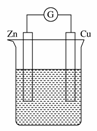
(5)如右图所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是________,正极反应是________。
解析:本题通过对溶液中离子浓度大小的判断,要求考生从多个角度、多个层次回答问题,全方位考查了考生分析问题和解决问题的能力及思维的严密性和有序性。
(1)若溶液中只溶解了一种溶质,且只存在OH-、H+、NH、Cl-四种离子,很容易得到溶质的名称是氯化铵;NH4Cl是强酸弱碱盐,NH4Cl===NH+Cl-,NH+H2ONH3·H2O+H+,NH水解使溶液显酸性。
(2)若符合四种离子的关系③,则溶液显碱性且c(NH)>c(Cl-),应是在溶液中加入了NH3·H2O或通入了NH3,溶液中溶质的化学式是NH4Cl和NH3(或NH4Cl和NH3·H2O);若四种离子的关系符合④,则溶液必加入了酸,而溶液中只存在OH-、H+、NH、Cl-四种离子,故溶质的化学式是NH4Cl和HCl。
(3)若将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,因NH4Cl溶液中存在NH+H2ONH3·H2O+H+水解平衡,因此加水稀释时,平衡会向右移动,其pH变化较HCl要小,故B图是正确的。
(4)溶液恰好呈中性,有c(NH)+c(H+)=c(Cl-)+c(OH-),NH4Cl水解使溶液显酸性,必定是氨水过量,故有:c(HCl)<c(NH3·H2O);盐酸中HCl是强电解质,而氨水中NH3·H2O是弱电解质,故有c(H+)>c(OH-)。
(5)由Zn-Cu-HCl组成的原电池,其负极材料是Zn,正极反应式为:2H++2e-===H2↑
答案:(1)NH4Cl ①
(2)NH4Cl和NH3·H2O NH4Cl和HCl
(3)B (4)小于 大于
(5)Zn 2H++2e-===H2↑
19.(12分)(2009·山东省济宁市高三第一学期质检)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量 浓度(mol/L) |
NaOH物质的 量浓度(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答下列问题:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸__________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2________(填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________。
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是________酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。c(Na+)-c(A-)=________mol/L。
解析:(1)因为是一元酸和一元碱等物质的量浓度等体积混合,说明恰好完全反应,生成的产物是NaA,对NaA溶液分析,若a=7,说明HA是强酸,若a>7,说明溶液是因为A-的水解而显碱性,则HA是弱酸。
(2)不一定等于0.2。当HA是强酸时等于0.2;当HA是弱酸时,大于0.2。因为pH=7,说明c(H+)=c(OH-),那么根据电荷守恒可知,一定有c(Na+)=c(A-)。
(3)由丙组实验数据可知,两溶液等体积等物质的量浓度混合后pH>7,说明A-水解,得到HA是弱酸,其他易推知。
(4)丁组实验中所得溶液的pH=9,说明溶液中c(H+)=10-9 mol·L-1,则由水电离产生的c(H+)+c(H+)=c(OH-)+c(A-),则c(Na+)-c(A-)=c(OH-)-c(H+)=(10-5-10-9)mol·L-1。
答案:(1)a=7时,HA是强酸,a>7时,HA是弱酸
(2)否 C
(3)弱 c(Na+)>c(OH-)>c(H+)
(4)10-5 10-5-10-9
18.(2009·北京市崇文区第一学期高三期末练习)下列比较中,正确的是 ( )
A.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大
B.0.2mol/L NH4NO3和0.1 mol/L NaOH溶液等体积混合后:c(NH)>c(NO)>c(Na+)>c(OH-)>c(H+)
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH)
D.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH)由大到小的顺序是:①>②>④>③
答案:D
第Ⅱ卷(非选择题,共46分)
17.(2009·上海市普陀区高三第一学期调研)已知H2CO3H++HCO,K1=4.3×10-7;HCO
 H++CO,K2=5.6×10-11;HClO
H++CO,K2=5.6×10-11;HClO
 H++ClO-,K=3.0×10-8,根据上述电离常数分析,下列各式中错误的是 ( )
H++ClO-,K=3.0×10-8,根据上述电离常数分析,下列各式中错误的是 ( )
A.Ca(ClO)2+2HCl===CaCl2+2HClO
B.Ca(ClO)2+2H2O+2CO2===Ca(HCO3)2+2HClO
C.NaClO+H2O+CO2===NaHCO3+HClO
D.2NaClO+H2O+CO2===Na2CO3+2HClO
答案:D
16.(2009·福建高三单科质检)有关常温下pH均为3的醋酸和硫酸的说法正确的是( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com