
题目列表(包括答案和解析)
17.室温下,某溶液中水电离出的H+和OH-的物质的量浓度乘积为1×10-26 mol2/L2,该溶液中一定不能大量存在的是( )
A.Cl- B.HCO
C.Na+ D.NO
解析:因1×10-26小于水的离子积常数,故该溶液为酸性溶液或碱溶液,HCO一定不能存在。
答案:B
16.1909年丹麦科学家Sorensen用公式pH=-lgc(H+)引入pH,1999年荷兰科学家HenK Van Lubeck提出酸度(AG)的概念,以更好地表示溶液的酸碱性。酸度(AG)的定义为AG=lg[],下列有关叙述中错误的是( )
A.常温时,中性溶液的pH=7,AG=0
B.酸性溶液的AG>0,AG越大,溶液的pH越小
C.碱性溶液的AG>0,AG越大,溶液的pH越大
D.常温下,0.1 mol/LNaOH溶液,AG=-12,pH=13
解析:对A项,pH=7,c(H+)=c(OH-),则AG=0。AG大说明c(H+)大,溶液pH小,B项对、C项错。D项AG=lg=-12。
答案:C
15.(2009·西城模拟)某二元弱酸的酸式盐NaHA溶液,若pH<7,则溶液中各离子的浓度关系不正确的是( )
A.c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.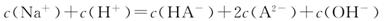






答案:C
14.(2009·崇文)95 ℃时,纯水中H+的物质的量浓度为10-6 mol/L。若将0.01 mol NaOH固体溶解在95 ℃水中配成1 L溶液,则溶液中由水电离出的H+的浓度(单位:mol/L)( )
A.10-6 B.10-10
C.10-8 D.10-12
答案:B
13.50 mL浓度为1 mol/L的CH3COOH(其电离程度小于1%)与100 mL NaOH溶液混合后,溶液的pH=7,对该溶液的有关叙述不正确的是( )
A.c(Na+)=c(CH3COO-)
B.原NaOH溶液的浓度为0.5 mol/L
C.原溶液中c(CH3COO-)>c(OH-)
D.原NaOH溶液的浓度小于0.5 mol/L
解析:溶液中只有H+、OH-、Na+、CH3COO-4种离子,因为pH=7,则H+、OH-浓度相等,由电荷守恒,c(Na+)=c(CH3COO-)所以A正确。由于主要溶质为CH3COONa,C正确。由于存在电离平衡,混合溶液中还有CH3COOH分子,则原NaOH溶液的浓度小于0.5 mol/L。
答案:B
12.将pH=3的盐酸和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是( )
A.c(NH)>c(Cl-)>c(H+)>c(OH-)
B.c(NH)>c(Cl-)>c(OH-)>c(H+)
C.c(Cl-)>c(NH)>c(H+)>c(OH-)
D.c(Cl-)>c(NH)>c(OH-)>c(H+)
解析:氨水存在电离平衡,与盐酸中和时平衡正向移动,电离出OH-,则c(OH-)>c(H+),再根据电荷守恒判断B正确。
答案:B
11.(2009·南宁质检)常温下,用0.1 mol/L的HCl溶液滴定a mL NaOH稀溶液,反应恰好完全时,消耗HCl溶液b mL,此时溶液中氢氧根离子的浓度c(OH-)是( )
A.1×10-7 mol/L B.1×107 mol/L
C. mol/L D. mol/L
答案:A
10.下列事实可以证明一水合氨是弱电解质的是( )
①0.1 mol/L的氨水可以使酚酞溶液变红
②0.1 mol/L的氯化铵溶液的pH约为5
③在相同条件下,氨水溶液的导电性比强碱溶液弱
④铵盐受热易分解
A.①② B.②③
C.③④ D.②④
解析:证明氨水中一水合氨是弱碱的基本原理有两个:(1)证明一水合氨不能完全电离,溶液中存在电离平衡,这也是最本质依据;(2)证明铵根离子水解(谁弱谁水解)。本题中选项②可以据(2)原理分析,选项③可以据(1)分析,而①和④都不能与以上两个原理结合起来,特别是①有迷惑性,①只说明一水合氨能电离而不能体现其电离程度。
答案:B
9.(2009·济南模拟)下列叙述中,错误的是( )
A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.纯水的pH随温度的升高而减小
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D.在纯水中加入少量硫酸铵,可抑制水的电离
解析:固体NaCl不导电,但熔融的NaCl或NaCl的水溶液都能导电,A正确。水的电离为吸热过程,随着温度的升高,纯水电离出的c(H+)增大,pH减小,B正确。在CH3COONa溶液中加入少量NaOH可使溶液中c(OH-)增大,C正确。选项D,纯水中加入少量(NH4)2SO4,NH与水电离出的OH-结合从而促进水的电离,故选项D错误。
答案:D
8.(2009·广州模拟)现有等体积的Ba(OH)2、KOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是( )
A.若混合前三种溶液pH相等,将它们同等倍数稀释后,则KOH溶液pH最大
B.若混合前三种溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3
C.若混合前三种溶液物质的量浓度相等,混合后恰好完全中和,则V1>V2>V3
D.若混合前三种溶液pH相等,混合后恰好完全中和,则V1>V2>V3
解析:A:若混合前三种溶液pH相等,稀释相同倍数,Ba(OH)2、KOH的pH比NH3·H2O大,但Ba(OH)2和KOH的pH相等;B:若三种溶液浓度相等,则与盐酸反应呈中性,需要盐酸:Ba(OH)2>KOH>NH3·H2O,正确;C:若完全中和,需要盐酸Ba(OH)2>KOH=NH3·H2O,即V1>V2=V3;D:若三者pH相等,酸碱完全中和,需要HCl:NH3·H2O>Ba(OH)2=KOH,即V3>V1=V2。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com