
题目列表(包括答案和解析)
2.下列说法正确的是( )
A.使元素的化合态转化成游离态的过程就是还原的过程
B.高炉炼铁的原料有铁矿石、焦炭和空气。工业上就是用焦炭还原铁矿石以制得生铁
C.电解熔融氧化铝时,每还原出1 kg铝,必有111 mol电子转移
D.工业上常用电解NaCl水溶液的方法制取金属钠
解析:元素有金属元素和非金属元素之分,使金属阳离子转化为金属单质的过程是借助还原反应。与之相反,使非金属阴离子转化为非金属单质的过程则是借助氧化反应,如2Br-+Cl2===2Cl-+Br2,所以选项A不正确。高炉炼铁中起还原剂作用的是CO,而并非焦炭,B错。Al-3e-===Al3+,冶炼1 kg Al共获得电子:n(e-)=×3=111.1 mol,所以C正确。D中NaCl水溶液里的H+得电子能力远比Na+强,所以不可能得到Na,只能得到H2。
答案:C
1.根据下图所示把煤隔绝空气加强热,下列叙述错误的是( )
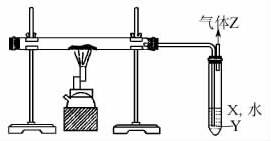
A.煤发生了化学变化
B.液体X的pH>7;Y是一种黑色黏稠状液体
C.气体Z易燃,可还原CuO,也可使溴水褪色
D.横玻璃管中产生浓的白烟
解析:煤的干馏是化学变化,A正确;煤的干馏产物X是粗氨水,显碱性,pH>7,Y是煤焦油,所以是黑色黏稠状液体,B正确;气体Z是焦炉气,其主要成分为CH4、H2、CO、C2H4,它是易燃气体,而且CO、H2均有还原性,能还原CuO,C2H4可与溴水发生加成反应而使溴水褪色,所以C正确;把煤隔绝空气加强热产生大量棕黄色烟而不会有浓的白烟生成,所以D错。
答案:D
22. 某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
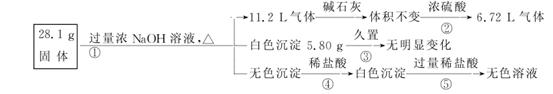
回答下列问题:
(1)混合物中是否存在FeCl2:____________(填“是”或“否”)。
(2)混合物中是否存在(NH4)2SO4:____________(填“是”或“否”)。
(3)写出反应④的离子方程式:________________________。
(4)请根据计算判断混合物中是否含有AlCl3(简述计算依据和计算结果,不要求写出完整的计算过程)。
解析:根据生成气体通过碱石灰体积不变(无酸性气体),而通过浓硫酸体积减小,说明剩余的 6.72 L气体为氢气,即原固体中一定含有金属Al,且其质量为×27 g/mol=5.4 g。生成氨气的物质的量为=0.2 mol,则原固体中一定含有 0.1 mol (NH4)2SO4,其质量为13.2 g。得到白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2,因此MgCl2的质量为9.5 g 。无色溶液中有Al与过量NaOH溶液反应后得到的NaAlO2。
答案:(1)否
(2)是
(3)AlO+H++H2O===Al(OH)3↓
(4)由题中信息可推得一定含有Al、(NH4)2SO4和MgCl2三种物质,而计算出这三种物质的质量之和刚好等于 28.1 g,所以一定没有AlCl3。
21.铝是一种重要的金属。
(1)铝在元素周期表中的位置是__________。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为__________________________。
(3)铝与NaOH溶液反应的离子方程式为____________________________;同温同压下,在浓度和体积均为100 mL 2 mol/L的盐酸及NaOH溶液中加入等质量的Al,产生气体的体积比为5∶6,则所加Al的质量为__________。
(4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括________________________,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明)____________________________________________。
解析:(3)2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,由上述两个方程式可以看出,当盐酸与NaOH的物质的量相同时,产生H2的体积比为1∶3,现为5∶6>1∶3,故加入的Al相对盐酸过量,对NaOH不足。0.2 mol的HCl需Al质量为×27 g/mol×0.2 mol=1.8 g,对应5份H2,当H2为6份时,铝的质量为×1.8 g=2.16 g,即为所求。
答案:(1)第3周期第ⅢA族
(2)2Al+Fe2O3高温Al2O3+2Fe
(3)2Al+2OH-+2H2O===2AlO+3H2↑ 2.16 g
(4)加热浓缩、冷却结晶、过滤
Al3++3H2O Al(OH)3+3H+,在干燥的HCl气流中,抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,故能得到 AlCl3。
Al(OH)3+3H+,在干燥的HCl气流中,抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水蒸气,故能得到 AlCl3。
20.实验室用下图所示仪器和药品做CO2和Na2O2反应制O2的实验,试填写下列空白。
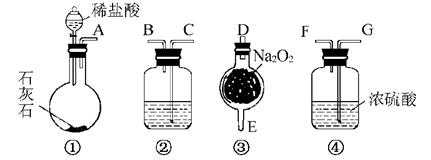
(1)装置②中所盛溶液最好选用__________。
A.饱和食盐水 B.饱和NaHCO3溶液
C.澄清石灰水 D.NaCl溶液
(2)如果将所制气体按从左到右流向排列装置时,上述各仪器装置连接的正确顺序是(填写装置的编号)________接__________接__________接__________,其中②③④之间的仪器接口顺序应为(用接口标识A、B、C……填写)__________。
(3)装置②的作用是____________________________________,发生反应的离子方程式是______________________________。
答案:(1)B (2)① ② ④ ③ A→C→B→G→F→D→E
(3)吸收HCl H++HCO===CO2↑+H2O
19.(2009·浙江金陵中学)铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为 Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
(1)对于问题1,同学们上网查找,有两种解释:
A.因为在铁表面上有黑色的铁的氧化物,所以叫黑色金属
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属
①你认为正确的说法是__________。
②若有一黑色粉末,如何鉴别是铁粉,还是Fe3O4?______________________________________。
③若有一黑色粉末,为铁和四氧化三铁的混合物,如何证明其中有Fe3O4(只要求简述实验方法)?____________________________________。
(2)对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将三氧化二铁高温灼烧,看灼烧前后颜色是否变化。
B.将三氧化二铁高温灼烧,看灼烧前后质量是否变化。
①实验中应将Fe2O3放在__________(填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由__________变为__________,说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗?__________,理由是________________________。
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为________,但是,实验结果固体灼烧前后质量比为30∶29,则高温灼烧后生成物是____________________。
④比较两种方法,你认为较好的方法是__________。
解析:(1)①B错误,因为Fe2O3是红棕色的;②常用的方法是加酸溶解,金属和稀盐酸反应生成氢气,而Fe3O4与稀盐酸反应时没有气泡产生;③鉴别混合物中是否有Fe3O4固体,可以用还原剂将氧化物还原,检验氧化产物,如用氢气还原,则检验是否有水生成,如用CO还原,则检验是否有CO2气体产生。
(2)②因为Fe2O3是红棕色的,FeO是黑色的,若方法A成立,那么颜色变化是由红棕色变为黑色,但从颜色并不能正确判断,因为可能生成黑色的Fe3O4,6Fe2O3高温4Fe3O4+O2↑;③若方法B成立,则下列反应成立:2Fe2O3高温4FeO+O2↑,灼烧前后的质量之比为:=10/9,若质量之比是30∶29,则发生了反应6Fe2O3高温4Fe3O4+O2↑,最后的分解产物是Fe3O4;④结合两种方法的分析,方法B更严密,此方法涉及了定量的计算,而方法A仅仅是定性地从颜色来观察,不严密。
答案:(1)①A ②取黑色粉末少许于试管中,加适量稀盐酸或稀硫酸,若有气泡产生则原黑色粉末为铁,若无气泡产生则原粉末为Fe3O4 ③用干燥的氢气与黑色粉末加热反应,用无水硫酸铜检测是否有水产生(或用纯净的一氧化碳与黑色粉末加热反应,用澄清石灰水检测是否有二氧化碳产生)(其他合理答案也可)
(2)①坩埚 ②红棕色 黑色 不能 也可能为Fe3O4 ③10/9 Fe3O4 ④B
18.有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.00 mol/L的NaOH溶液时,得到沉淀最多。上述盐酸溶液的浓度为( )
A.0.050 mol/L B.1.00 mol/L
C.2.00 mol/L D.3.00 mol/L
解析:得到沉淀最多时溶液为NaCl溶液,n(Na+)=n(Cl-)=n(HCl)=0.25 L×2 mol/L=0.5 mol
c(HCl)==1 mol/L。
答案:B
第Ⅱ卷(非选择题,共46分)
17.正在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O。以下叙述正确的是( )
A.铝热剂就是单指Fe2O3和铝粉的混合物
B.检验红砖中的红色物质是否是Fe2O3的操作步骤是:样品―→粉碎―→加水溶解―→过滤―→向滤液中滴加KSCN溶液
C.分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为3∶2∶3
D.明矾含有结晶水,是混合物
解析:铝热剂是某些金属氧化物与铝粉的混合物,不专指Fe2O3和铝粉的混合物,A不正确;由于Fe2O3不溶于水,所以在经过所给操作步骤得到的滤液中不含Fe3+,该操作不能达到目的,故B不正确;C选项中氧化剂Fe2O3的物质的量一样多,故H2、Al、CO失电子的物质的量一样多,即n(H2)·2=n(Al)·3=n(CO)·2,所需H2、Al、CO的物质的量之比为3∶2∶3,C正确;明矾虽然含结晶水,但其组成一定,故为纯净物。
答案:C
16.能与Fe3+反应,且证明Fe3+具有氧化性的是( )
①SCN- ②Fe ③Fe2+ ④Cu ⑤SO ⑥OH-
A.①②③ B.②④ C.①③⑥ D.①②⑤
解析:Fe3+与SCN-和OH-反应是非氧化还原反应,与Fe2+和SO不反应。
答案:B
15.常温下,将0.1 mol的金属钠、镁、铝分别投入到100 mL 0.5 mol/L的盐酸中,完全反应后产生的氢气是( )
A.镁、铝一样多 B.钠放出的多
C.镁放出的多 D.铝放出的多
解析:对镁、铝而言,酸不足量,产生H2的量取决于酸的量,都为0.025 mol;Na能与水反应,产生H2的量取决于钠的量,应产生0.05 mol H2。
答案:AB
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com